
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Методика и порядок выполнения работы
Опыт 1. Приготовление 
 раствора
раствора  методом разбавления концентрированного раствора
методом разбавления концентрированного раствора
1.1. Выписать значение плотности раствора  (измеряется ареометром или задается преподавателем) и по справочнику Лурье определить её массовую концентрацию
(измеряется ареометром или задается преподавателем) и по справочнику Лурье определить её массовую концентрацию  .
.
1.2. Рассчитать массу кислоты в заданном растворе по формуле (5.1):
 , (5.1)
, (5.1)
где 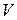 – объем заданного раствора,
– объем заданного раствора,  ;
;  – концентрация моля – эквивалентов (нормальность) заданного раствора,
– концентрация моля – эквивалентов (нормальность) заданного раствора,  .
.
Зная  , массу
, массу  и плотность концентрированного раствора
и плотность концентрированного раствора  , определить объем концентрированной кислоты
, определить объем концентрированной кислоты  по формуле (5.2):
по формуле (5.2):
 . (5.2)
. (5.2)
1.3. В мерный цилиндр на  налить половину заданного объема воды. Пальчиковой пробиркой отмерить рассчитанный объем концентрированной кислоты
налить половину заданного объема воды. Пальчиковой пробиркой отмерить рассчитанный объем концентрированной кислоты  и перенести его в мерный цилиндр. Долить дистиллированной воды до метки
и перенести его в мерный цилиндр. Долить дистиллированной воды до метки  и перелить полученный рабочий раствор
и перелить полученный рабочий раствор  в индивидуальную посуду, поставить в шкаф для хранения.
в индивидуальную посуду, поставить в шкаф для хранения.
Запись данных опыта. Отчет оформить на новом листе, где привести все расчеты в общем и численном виде, а результаты занести в таблицу 5.1.
Таблица 5.1 – Приготовление рабочего раствора 
Объем раствора  , ,

| Концентрация раствора  , ,  , ,

| Масса  в растворе в растворе

| Плотность конц.
раствора 

| Массовая доля конц. 

| Объем конц.
раствора  , ,

|
Опыт 2. Приготовить 
 раствора
раствора 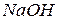 методом разбавления
методом разбавления
2.1. Рассчитать массу 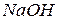 в заданном растворе по формуле (5.1).
в заданном растворе по формуле (5.1).
2.2. По значению титра  концентрированного раствора
концентрированного раствора 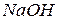 (указан на склянке с реактивом) и вычисленной массе вещества в рабочем растворе рассчитать объем
(указан на склянке с реактивом) и вычисленной массе вещества в рабочем растворе рассчитать объем  концентрированного раствора
концентрированного раствора 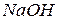 по формуле:
по формуле:
 , (5.3)
, (5.3)
где  – титр раствора,
– титр раствора,  – масса вещества в
– масса вещества в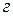 ,
,  – объем раствора в
– объем раствора в  .
.
2.3. Для приготовления раствора 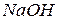 взять цилиндр или мерный стакан на
взять цилиндр или мерный стакан на  и налить до половины его объема дистиллированной воды. Отмерить пальчиковой пробиркой рассчитанный объем концентрированного раствора
и налить до половины его объема дистиллированной воды. Отмерить пальчиковой пробиркой рассчитанный объем концентрированного раствора 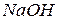 и перенести его в цилиндр. Объем раствора довести до заданного и перелить в индивидуальную посуду, плотно укупорить и поставить в отведенное место для хранения.
и перенести его в цилиндр. Объем раствора довести до заданного и перелить в индивидуальную посуду, плотно укупорить и поставить в отведенное место для хранения.
Запись данных опыта. Отчет оформить на новом листе, где необходимо привести все расчеты в общем и численном виде, а результаты занести в таблицу 5.2.
Таблица 5.2 – Приготовление рабочего раствора 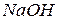
Концентрация раствора  , ,
 , , 
| Масса  в растворе,
в растворе, 
| Титр конц. раствора  , , 
| Объем конц. раствора  , ,
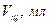
|
Содержание отчета и его форма
Каждый студент должен иметь лабораторный журнал, который является документом, отражающим всю его работу.
Все наблюдения и выводы по экспериментальной работе, проделанной в лаборатории, студент заносит в лабораторный журнал непосредственно после ее выполнения в виде отчета.
Рекомендуется следующая схема записи:
1. Дата.
2. Номер и название лабораторной работы.
3. Цель работы.
4. Название и описание хода опытов.
5. Наблюдения.
6. Уравнения химических реакций.
7. Выводы и расчеты (формулы, таблицы, графики).
Вопросы для защиты работы
1. К какой группе методов и почему относится кислотно-основное титрование?
2. Растворы, применяемые в титриметрии и способы их приготовления.
3. Что понимают под терминами: 1) стандартный титрованный раствор; 2) стандартный раствор, 3) рабочий раствор; 4) раствор с приготовленным титром; 5) раствор с установленным титром?
4. Требования, предъявляемые к рабочим растворам в титриметрии.
5. Перечислите виды посуды, применяемой в количественном анализе.
6. Какую посуду и весы используют при приготовлении растворов: а) с установленным титром; б) с приготовленным титром? Ответ обосновать.
7. Какой титрованный раствор называют стандартным? Чем он отличается от других титрованных растворов?
8. Укажите, какие из перечисленных ниже веществ:  ,
,  ,
, 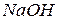 ,
, 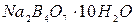 ,
,  ,
,  ,
,  являются: а) стандартными; б) растворами с приготовленным титром; в) растворами с установленным титром?
являются: а) стандартными; б) растворами с приготовленным титром; в) растворами с установленным титром?
9. Что такое фиксанал? Для чего его применяют? Как правильно готовить раствор из фиксанала? Какую посуду при этом надо применять?
10. Какие реакции могут протекать при хранении щелочей?
11. Почему при приготовлении растворов щелочей используют только свежеприготовленную и прокипяченную дистиллированную воду?
12. Как правильно готовить растворы кислот, щелочей и солей с использованием: цилиндра, мерной колбы?
13. Назовите основные методы классического количественного химического анализа. На чем основано определение веществ в каждом из них?
| <== предыдущая страница | | | следующая страница ==> |
| Приборы и реактивы | | | Теоретическое обоснование. Растворы с приготовленным титром или первичные стандарты используют для установления концентрации вторичных стандартов и рабочих растворов щелочей |
Дата добавления: 2015-07-26; просмотров: 168; Нарушение авторских прав

Мы поможем в написании ваших работ!