
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Обобщение сведений о группах углеводородов
| Характе-ристика | алканы | алкены | алкадиены | алкины | циклоалканы | ароматические у\в |
| общая формула | CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n | CnH2n-6 |
| первый гомолог | CH4 | CH2 = CH2 | CH2 = C = CH2 | CH º CH | CH3 CH3 ∆CH3 | 
|
| вид гибри- дизации | sp3 | sp2 | sp2 | sp | sp3 | sp2 |
| вид ковал. Связи | σc-c σC-H | σc-c σC-H πc-c | σc-c σC-H πc-c | σc-c σH-H πc-c | σc-c σC-H | σc-c σC-H 6π- |
| угол между связями | 109028/ | 1200 | 1200 | 1800 | В зависимости от формы цикла | 1200 |
| длина связи С-С, нм | 0,154 | 0,134 | 0,134 | 0,120 | 0,154 | 0,140 |
| вид изомерии | 1)изомерия у/в скелета | 1) изомерия у/в скелета 2) изомерия положения кратной связи 3) межклассовая изомерия циклоалканам 4) геометрическая изомерия (цис-транс) | 1) изомерия у/в скелета 2) изомерия положения кратной связи 3) межклассовая изомерия с алкинами 4) геометрическая изомерия (цис-транс) | 1) изомерия у/в скелета 2) изомерия положения кратной связи 3) межклассовая изомерия с алкадиенами | 1) изомерия положения заместителей 2) межклассовая изомерия с алкенами | 1) изомерия положения заместителей |
| Химические свойства | Характерны реакции замещения | Характерны реакции присоединения | Характерны реакции присоединения | Характерны реакции присоединения | Для малых циклов характерны реакции присоединения, а для циклов, содержащих 5 и более атомов углерода- реакции замещения. | Характерны реакции замещения |
Получение углеводородов
| Алканы | Алкены | Алкадиены | Алкины | Циклоалканы | Ароматические у/в |
| I ) В промышленности Алканы выделяют из природных источников (природный газ, нефть, уголь и т.д). II) Синтетические способы 1)Гидрирование алкенов CH3-CH=CH2 + H2→ CH3-CH2-CH3 2) Декарбоксилирование натриевых солей карбоновых кислот CH3COONa +NaOH→ CH4 + Na2CO3 3)Синтез Вюрца 2CH3-CH2Br + 2Na→ CH3-CH2-CH2-CH3 +2NaBr 4) Гидролиз карбидов Al4C3 +12H2O →3CH4+ 4Al(OH)3 |
1)Крекинг нефтепродуктов
C16H34 →C8H18 + C8H16
Гексадекан →октан и октен
2)Дегидрирование алканов
(Pt, Ni, Al2O3, 400-600o)
CH3-CH2-CH3→
CH3-CH=CH2
3)Дегидратация спиртов
 CH3-CH2-OH H2SO4
CH2=CH2 + H2O
4) Дегидрогалогенирование
CH3-CH(Br)-CH2-CH3 + NaOH (спирт. р-р)→
CH3-CH=CH-CH3 +NaBr + H2O
Правило Зайцева!
5) Дегалогенирование
CH3-CH(Br)-CH(Br)-CH3 + Zn→
CH3-CH=CH-CH3 +ZnBr2 CH3-CH2-OH H2SO4
CH2=CH2 + H2O
4) Дегидрогалогенирование
CH3-CH(Br)-CH2-CH3 + NaOH (спирт. р-р)→
CH3-CH=CH-CH3 +NaBr + H2O
Правило Зайцева!
5) Дегалогенирование
CH3-CH(Br)-CH(Br)-CH3 + Zn→
CH3-CH=CH-CH3 +ZnBr2
|
1)Метод Лебедева
 2CH3-CH2-OH Al2O3, ZnO
CH2=CH-CH=CH2 +
2H2O + H2
2) Дегидрирование 2CH3-CH2-OH Al2O3, ZnO
CH2=CH-CH=CH2 +
2H2O + H2
2) Дегидрирование
 CH3-CH2-CH2-CH3 Al2O3
CH2=CH-CH=CH2
3) Дегидрогалогенирование
CH2(Br)-CH2-CH2(Br) +
2KOH→ 2KBr + 2H2O +
CH2=CH-CH=CH2 CH3-CH2-CH2-CH3 Al2O3
CH2=CH-CH=CH2
3) Дегидрогалогенирование
CH2(Br)-CH2-CH2(Br) +
2KOH→ 2KBr + 2H2O +
CH2=CH-CH=CH2
|
1)Карбидный способ
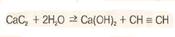 2)Метановый способ
2)Метановый способ
 2CH4 1500C CH≡CH + 3H2
3)Дегидрогалогенирование
CH3-CH(Br)-CH(Br)-CH3 + 2KOH (спирт.)→ CH3-C≡C-CH3 + 2KBr + 2H20
CH3-C(Br2)-CH3 + 2KOH (спирт)→ CH3-C≡CH +2KBr + 2H20 2CH4 1500C CH≡CH + 3H2
3)Дегидрогалогенирование
CH3-CH(Br)-CH(Br)-CH3 + 2KOH (спирт.)→ CH3-C≡C-CH3 + 2KBr + 2H20
CH3-C(Br2)-CH3 + 2KOH (спирт)→ CH3-C≡CH +2KBr + 2H20
|
1)Гидрирование бензола
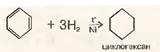 2) Дегалогенирование дигалогенопроизводных
Br-CH2-CH2-CH2-Br + Zn
→
2) Дегалогенирование дигалогенопроизводных
Br-CH2-CH2-CH2-Br + Zn
→  + ZnBr2 + ZnBr2
|
1)Дегидрирование циклогексана
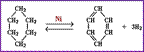 2)Ароматизация алканов
CH3-(CH2)4-CH3
2)Ароматизация алканов
CH3-(CH2)4-CH3
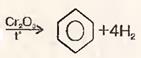 3) Тримеризация ацетилена
3) Тримеризация ацетилена
 4) Синтез Вюрца
4) Синтез Вюрца
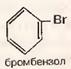 + CH3-Br + Na→
+ CH3-Br + Na→
 + NaBr + NaBr
|
Химические свойства
| Алкены | Алкадиены | Алкины | |
1)Гидрирование
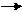 CH3-CH2-CH=CH2 +H2 Pt CH3-CH2-CH2-CH3
2)Галогенирование (бромная вода обесцвечивается)
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3
3)Гидрогалогенирование
CH2=CH-CH3 + HBr → CH3-CHBr-CH3
Правило Марковникова!
4)Гидратация
CH2=CH-CH3 + H2O→CH3-CHOH-CH3
5)Полимеризация CH3-CH2-CH=CH2 +H2 Pt CH3-CH2-CH2-CH3
2)Галогенирование (бромная вода обесцвечивается)
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3
3)Гидрогалогенирование
CH2=CH-CH3 + HBr → CH3-CHBr-CH3
Правило Марковникова!
4)Гидратация
CH2=CH-CH3 + H2O→CH3-CHOH-CH3
5)Полимеризация
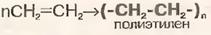 6)Окисление (р-р KMnO4 обесцвечивается)
6)Окисление (р-р KMnO4 обесцвечивается)
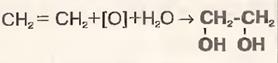 7)Горение
CH2=CH2 + 3O2 → 2CO2 + 2H2O
7)Горение
CH2=CH2 + 3O2 → 2CO2 + 2H2O
| 1)Гидрирование
CH2=CH-CH=CH2 + H2→ CH3-CH=CH-CH3
2) Галогенирование
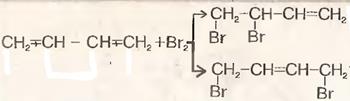 3)\Полимеризация
3)\Полимеризация
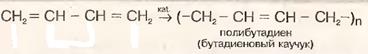
|  5) Взаимодействие с основаниями
5) Взаимодействие с основаниями
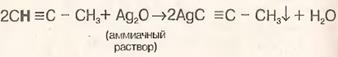
|
| <== предыдущая страница | | | следующая страница ==> |
| Мембраны | | | В настоящем Федеральном законе |
Дата добавления: 2015-07-26; просмотров: 356; Нарушение авторских прав

Мы поможем в написании ваших работ!