
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Классификация по характеру разрыва связей
В органических реакциях возможны два вида разрыва связей: гомолитический и гетеролитический.
Гомолитический разрыв связи происходит, когда электронная пара делится пополам между атомами и образуются частицы, называемые свободными радикалами:
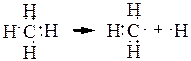
метан радикал атом
метил водорода
Свободный радикал – это электронейтральная частица, имеющая один или несколько неспаренных электронов и способная к самостоятельному существованию.
Гомолитическому разрыву связи способствуют нагревание, свет и механическое воздействие. Обычно радикальному разрыву подвергаются неполярные и малополярные связи.
Реакции, проходящие с гомолитическим разрывом старых связей и образованием в промежуточном состоянии радикалов, называются радикальными. Например:
СН4 + Сl2  CH3Cl + HCl*.
CH3Cl + HCl*.
Гетеролитический (ионный) разрыв связи происходит, когда электронная пара переходит к более электроотрицательному атому и образуются ионы:
Н3С:I ® H3C+ + I–
иодметан ион карбения иодид-ион
Н3С:Li ® H3C– + Li+
метиллитий метанид-ион ион лития
Частица с положительным зарядом на атоме углерода называется карбкатионом (карбениевым ионом), а с отрицательным – карбанионом.
Гетеролитическому разрыву связи способствует наличие полярного растворителя (например, воды). К нему склонны сильно полярные и легко поляризуемые связи.
Реакции, проходящие с гетеролитическим разрывом старых связей и образованием в промежуточном состоянии ионов, называются ионными. Например:
СН3–СН=СН2 + НВr ® СН3–СНВr–СН3**.
| <== предыдущая страница | | | следующая страница ==> |
| Классификация органических реакций | | | Классификация по реагирующим частицам |
Дата добавления: 2015-07-26; просмотров: 250; Нарушение авторских прав

Мы поможем в написании ваших работ!