
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
В водном растворе карбоновые кислоты диссоциируют с образованием карбоксилат-аниона и иона водорода.
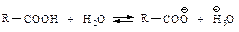
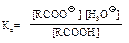
Константы их кислотности Ка приблизительно равны 10-5. Даже будучи слабыми кислотами, они на много порядков более сильные кислоты, чем спирты. Это можно объяснить отсутствием в алкоксид-ионах стабилизации, которая имеет место в карбоксилат-ионах.
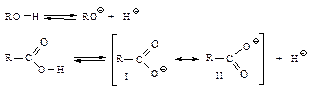
Карбоксилат-ион представляет собой резонансный гибрид двух структур (I) и (II), атом углерода связан с каждым атомом кислорода одной полуторной связью, два p-электрона распределены на трех орбиталях одного атома углерода и двух атомов кислорода. Такая делокализация электронного облака делает анион-сопряженное основание более устойчивым, более слабым, а кислоту – более сильной.
Соли. Поскольку карбоновые кислоты более сильные кислоты, чем вода, они легко переводятся в соли водными растворами щелочей. Под действием водных растворов минеральных кислот соли легко превращаются обратно в кислоты.
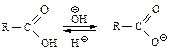
Соли натрия, калия, аммониевые соли карбоновых кислот растворимы в воде, но не растворяются в органических растворителях. Карбоновые кислоты и их соли щелочных металлов обладают противоположными характеристиками растворимости (за исключением С1–С4 – кислот, которые растворяются и в воде, и в органических растворителях). Это используют для очистки карбоновых кислот от органических примесей.
Влияние заместителей на кислотность. Электроноакцепторные заместители, способствующие распределению отрицательного заряда в анионе, делают его более устойчивым и тем самым увеличивают кислотность. Электронодонорные заместители увеличивают отрицательный заряд и дестабилизируют анион – кислотность уменьшается.
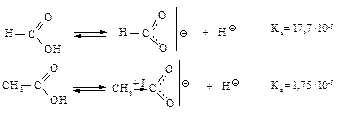
Электронодонорная группа -СН3 подает электроны, дестабилизирует анион, уменьшает кислотность.
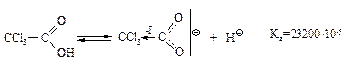
Электроноакцепторная группа -ССl3 способствует распределению заряда, стабилизирует анион, увеличивает кислотность.
Для ароматических кислот влияние аналогичное. Следует учесть, что группы, проявляющие эффект сопряжения, самое сильное влияние на кислотность оказывают в том случае, когда они находятся в п-положении по отношению к карбоксильной группе.
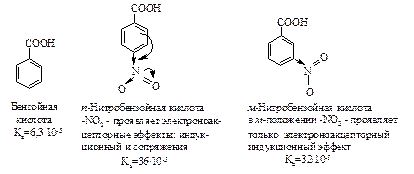

Почти все о-замещенные ароматические кислоты более сильные, чем бензойная кислота, независимо от характера о-заместителя.
| <== предыдущая страница | | | следующая страница ==> |
| Строение и физические свойства. Карбоксильная группа представляет собой сочетание карбонильной и гидроксильной групп | | | Реакции, сопровождающиеся разрывом связи С-ОН. Превращение в функциональные производные |
Дата добавления: 2015-07-26; просмотров: 307; Нарушение авторских прав

Мы поможем в написании ваших работ!