
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Реакционная способность
Ацильные соединения, т.е. карбоновые кислоты и их функциональные производные, вступают в реакции нуклеофильного замещения групп Х: –ОН, –Сl, –OCOR, –OR, NH2.

Первая стадия нуклеофильной атаки по карбонильному углероду одинакова для альдегидов, кетонов и ацильных соединений – образование продукта присоединения по двойной связи. Как и в случае альдегидов и кетонов, пространственные и электронные факторы делают карбонильную группу доступной для атаки нуклеофильным реагентом: а) атака нуклеофила по углероду плоской группы 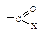 не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).

В случае ацильных соединений стабилизация промежуточного аниона происходит путем отщепления групп, которые являются слабыми основаниями Сly, RCOOy или сравнительно сильными основаниями R1Oy, NH2y. У альдегидов и кетонов во второй стадии реакции не происходит отщепления ионов Нy или Ry, так как они являются самыми сильными основаниями и, следовательно, очень “плохими” уходящими группами, поэтому вместо отщепления Нy или Ry происходит присоединение НÅ.
Таким образом, нуклеофильное замещение в ацильных производных происходит в две стадии: 1) нуклеофильное присоединение по двойной связи 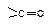 с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду
с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду
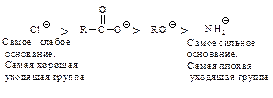
По легкости протекания второй стадии ацильные производные располагаются в следующий ряд:
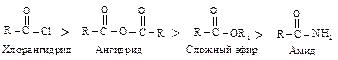
Как и в реакциях альдегидов и кетонов, в случае слабого нуклеофила (Н2О, RОН) реакция катализируется кислотой: во-первых, протон НÅ делает карбонильную группу более доступной для нуклеофильной атаки (I), во-вторых, в этом случае образуется устойчивый незаряженный промежуточный продукт (II)
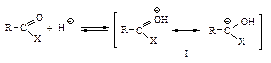
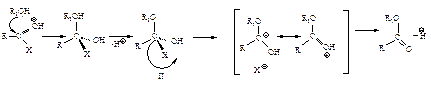
Хлорангидриды и ангидриды очень реакционноспособные соединения; даже со слабыми нуклеофилами они реагируют без катализатора. Например, хлористый ацетил бурно реагирует с водой, хлорангидриды ароматических кислот менее реакционноспособны.
| <== предыдущая страница | | | следующая страница ==> |
| Функциональные производные карбоновых кислот | | | Реакции замещения группы Х у карбонильного атома углерода |
Дата добавления: 2015-07-26; просмотров: 293; Нарушение авторских прав

Мы поможем в написании ваших работ!