
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Конструкционные материалы на основе железа
Коррозионная характеристика металлов – 4 часа.
Коррозионная характеристика железо-углеродистых сплавов. Основные принципы создания коррозионностойких сталей и сплавов.
Конструкционные материалы на основе железа
Конструкционные материалы на основе железа — чугуны и стали — являются самыми распространенными конструкционными материалами как по объему их производства, так и по частоте использования.
Железо существует в двух аллотропических формах aи γ a-железо называется ферритом, оно магнитно, имеет ОЦК решетку 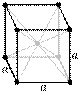 и стабильно при Τ < 910°С и Τ > 1401°С. Устойчивая при высоких температурах форма феррита называется δ-феррит. γ-железо имеет ГЦК решетку, не обладает магнитными свойствами и называется аустенитом. ПДК в воде — 0,1 мг/л. Железо (так же, как хром и марганец) относится к черным металлам. В природе оно всегда существует в окисленной форме (в виде руд), содержащей в своем
и стабильно при Τ < 910°С и Τ > 1401°С. Устойчивая при высоких температурах форма феррита называется δ-феррит. γ-железо имеет ГЦК решетку, не обладает магнитными свойствами и называется аустенитом. ПДК в воде — 0,1 мг/л. Железо (так же, как хром и марганец) относится к черным металлам. В природе оно всегда существует в окисленной форме (в виде руд), содержащей в своем  составе также С, О, S, Mn, Cr, Ni и другие элементы.
составе также С, О, S, Mn, Cr, Ni и другие элементы.
Стандартный потенциал для реакции Fe2+ + 2е ↔ Fe равен
-0,44 В, а для реакции Fe3+ + Зе ↔ Fe равен -0,036 В. Однако реально измеряемый на практике потенциал значительно отличается от равновесного.
В присутствие кислорода или других окислителей железо пассивируется и его стационарный потенциал приближается к +0,1 В. Если в растворе находится ион водорода или галоидные ионы, потенциал железа сдвигается в отрицательную сторону и может достигать значений -0,6 В.
В большинстве сред, за исключением растворов минеральных кислот, при коррозии железа образуются нерастворимые продукты коррозии — ржавчина.
Первичный анодный процесс приводит к образованию ионов двухвалентного железа Fe2+. В нейтральных растворах образуется гидроксид Fe(II)-Fe(OH)2, растворимость которого равна 1,64 x 10-3 г/л. При наличии в растворе О2 протекает дальнейшая реакция — образование гидроксида трехвалентного железа Fe(OH)3:
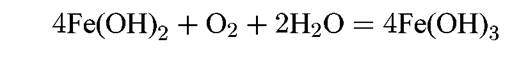
Последний имеет растворимость 4,8 x 10-8 г/л, т.е. значительно меньше, чем Fe(OH)2.
Образование ржавчины происходит в растворе в непосредственной близости от корродирующей поверхности. Ржавчина покрывает металл рыхлым слоем. Она обладает плохим сцеплением с металлической поверхностью и поэтому плохо защищает железо от коррозии. Состав ржавчины может быть переменным и его выражают общей формулой:
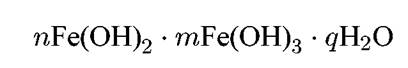
где n,m,q — целые числа.
Железо не является коррозионностойким материалом. В атмосферных условиях скорость его коррозии в 5-10 раз превышает скорость коррозии цинка, никеля, меди.
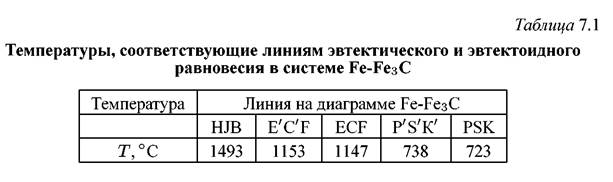
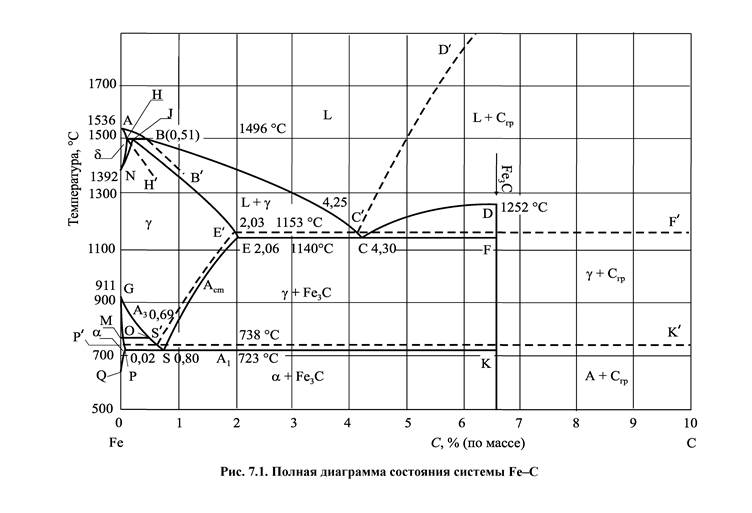
Практически все конструкционные материалы на основе железа в тех или иных количествах содержат в своем составе углерод. Рассмотрим диаграмму фазового равновесия Fe-C. Первым исследователем указанной диаграммы был Д.К. Чернов, который обнаружил так называемые «критические точки» (температуры):
770 °С — магнитное превращение (точка Кюри);
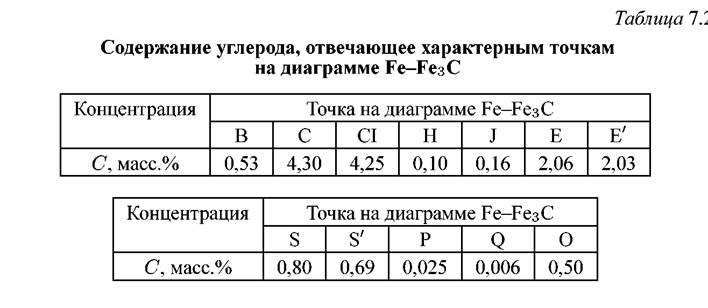
910 °С — превращение a →γ ;1401 °С —превращение γ → α(δ); 1534°С —плавление; 3200 °С — кипение. Однако поскольку растворимость самого углерода в железе низка и при превышении предела его растворимости выделяется карбид железа — цементит (Fe3С), то, как правило, рассматривают не стабильную диаграмму состояний Fe-C, а метастабильную Fe-Fe3С (рис. 7.1). На диаграмме соответственно сплошными и пунктирными линиями обозначено метастабильное и стабильное равновесие. Линии АВ, ВС, CD являются линиями солидус, линии АН, HN, JE — ликвидус. Линии NH, NJ, ES, E’S’, GO, GS, GP, OS, PK, P'K', PQ, МО, очерчивают области равновесий, имеющих место в твердой фазе. Линии HJB, E'C'F, ECF являются линиями эвтектического, а линии P'S'K7 и PSK — эвтектоидного равновесия. Указанным линиям соответствуют следующие температуры (табл. 7.1.)
 |
| <== предыдущая страница | | | следующая страница ==> |
| III. Тестовое задание | | | Стали и чугуны |
Дата добавления: 2015-07-26; просмотров: 320; Нарушение авторских прав

Мы поможем в написании ваших работ!