
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Сильные электролиты. Активность электролитов
Сильные электролиты в растворе полностью распадаются на ионы. Уравнение процесса электролитической диссоциации сильного электролита записывается с указанием его практической необратимости: приводится лишь одна стрелка  , направленная от молекулярной формы электролита к его ионам, например:
, направленная от молекулярной формы электролита к его ионам, например:
HNO3 → H+ + N 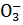 .
.
Так как количество ионов в растворах сильных электролитов велико, а расстояние между ними малы, наблюдается сильное электростатическое взаимодействие между ионами противоположного знака.
Вследствие этого растворы сильных электролитов ведут себя так, как будто число частиц в растворе меньше их реального количества, а все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было бы меньше, чем это соответствует полной концентрации электролита. Поэтому во все законы, описывающие сильные электролиты, входит не концентрация вещества, а его активность.
Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона а равна его концентрации с, умноженной на коэффициент активности f:
a = f∙ c.
В разбавленных растворах взаимодействие между ионами мало и f = 1, следовательно, a = c, (то есть активность совпадает с концентрацией).
В концентрированных растворах взаимодействие между ионами значительно, f меньше единицы и a меньше с.
| <== предыдущая страница | | | следующая страница ==> |
| Слабые электролиты. Закон разбавления Оствальда | | | Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации |
Дата добавления: 2014-05-03; просмотров: 417; Нарушение авторских прав

Мы поможем в написании ваших работ!