
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
Рассмотрим в свете ТЭД свойства веществ, которые в водном растворе проявляют свойства электролитов.
5.1. Кислоты
Для кислот характерны следующие общие свойства:
а) способность взаимодействовать с основаниями с образованием солей;
б) способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
в) кислый вкус.
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. С устранением ионов водорода, например, при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
Одноосновные кислоты диссоциируют в одну ступень:
HNO3 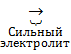 H+ + N
H+ + N 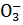 .
.
Многоосновные кислоты диссоциируют ступенчато:
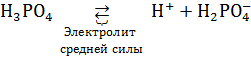 ;
;
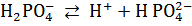 ;
;
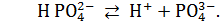
При составлении уравнений диссоциации следует помнить, что суммы зарядов в левой и правой частях уравнения должны быть одинаковыми.
5.2. Основания
Для водных растворов оснований характерны следующие общие свойства:
А) Способность взаимодействовать с кислотами с образованием солей;
б) способность изменять цвет индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразный «мыльный» вкус
Поскольку общими для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания – это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Однокислотные основания диссоциируют в одну ступень:
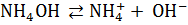 .
.
Многокислотные основания диссоциируют ступенчато:
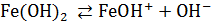 ,
,
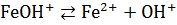 .
.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
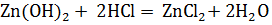 ,
,
А при взаимодействии с гидроксидом натрия при недостатке воды – цинкат натрия:
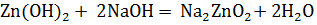 .
.
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами или амфотерными амфолитами – амфолитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома(III),железа(III), меди(II), олова(IV) и другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул, возможна, следовательно, по местам обеих связей. Например, диссоциацию гидроксида цинка можно выразить схемой:

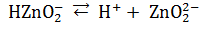
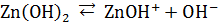

Таким образом, в растворе амфотерного электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
5.3. Соли
Таких ионов, которые были бы общими для водных растворов всех солей, нет, поэтому соли и не обладают общими свойствами.
С точки зрения ТЭД соли – это электролиты, которые при растворении в воде диссоциируют на катионы металла и анионы кислотного остатка.
Средние соли диссоциируют в одну ступень
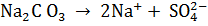
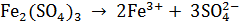
Кислые соли диссоциируют ступенчато: сначала отщепляются все катионы металла, а затем – по одному – ионы водорода.

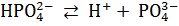
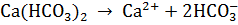
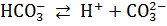
Основные соли диссоциируют ступенчато: сначала отщепляются все ионы кислотных остатков, а затем – по одному – гидроксид-ионы.
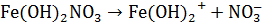 ,
,
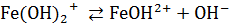 ,
,
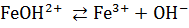 .
.
Таким образом, при составлении уравнений диссоциации следует помнить: катионы водорода и гидроксид-ионы диссоциируют ступенчато, а катионы металлов и анионы кислотных остатков – сразу, в одну ступень.
| <== предыдущая страница | | | следующая страница ==> |
| Сильные электролиты. Активность электролитов | | | Реакции ионного обмена |
Дата добавления: 2014-05-03; просмотров: 1601; Нарушение авторских прав

Мы поможем в написании ваших работ!