
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ В ПОЧВАХ
|
Читайте также: |
Одним из факторов фазовых переходов веществ в почвах являются окислительно-восстановительные процессы. Многие из них обратимы, и соединения элементов с переменной зарядностью многократно переходят из одной фазы в другую.
Окислением (Ох) в химии называется процесс отдачи электронов химическими элементами, а восстановлением (Red) — их приобретение:
Ox 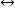 Red.
Red.
Окисление одного элемента, отдающего электроны, обязательно сопровождается восстановлением другого элемента, приобретающего их. Поэтому говорят об окислительно-восстановительных реакциях или процессах.
Главным окислителем в почвах является кислород почвенного воздуха и растворенный в почвенной влаге. В качестве восстановителей выступают органическое вещество, водород и сероводород. Некоторые реакции окисления, как, например, органических веществ, необратимы. Гумификация и минерализация органических остатков при достаточном доступе кислорода воздуха — процесс окислительный — необратимый.
Многие окислительно-восстановительные процессы имеют обратимый характер: химические элементы многократно могут переходить из окисленного в восстановленное состояние и обратно. Широко распространены обратимые процессы окисления и восстановления железа (Fe3+ 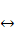 Fe2+), марганца (Мп4+
Fe2+), марганца (Мп4+ 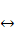 Мп2+), серы (S2
Мп2+), серы (S2 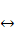 S6+), азота (N5+
S6+), азота (N5+ 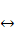 N3+).
N3+).
В обратимых окислительно-восстановительных процессах один и тот же элемент в зависимости от степени ионизации и условий среды (кислородной О2, бескислородной глеевой СН4, сероводородной H2S) является или окислителем, или восстановителем.

Состояние окислительно-восстановительных условий в почве
характеризуется особым показателем — окислительно-восстановительным потенциалом (ОВГ1) атомов или ионов относительно какой-либо стандартной окислительно-восстановительной реакции, потенциал которой приравнивается к нулю. В качестве такой реакции принято считать переход водорода из газообразного состояния в состояние иона:
Н2—2е = 2Н+.
Потенциал окислительно-восстановительной системы (в данном случае почвы) по отношению к нормальному водородному электрону обозначается индексом Eh; Eh = Е0 +0,0291g 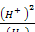 вольт (для температуры 18 °С). Окислительно-восстановительные процессы зависят от величины рН — в щелочной среде окисление идет при более
вольт (для температуры 18 °С). Окислительно-восстановительные процессы зависят от величины рН — в щелочной среде окисление идет при более
низких значениях Eh, чем в кислой (рис. 12.1). Кислотно-щелочные
условия окислительно-восстановительных реакций учитываются введением показателя гН2:
гН2 = 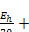 2РН.
2РН.
Значения Eh колеблются от 600—750 мВ в хорошо аэрируемых почвах с окислительным режимом до 150—200 мВ в почвах переувлажненных с восстановительными условиями; в резко восстановительной сероводородной обстановке Еh опускается ниже нуля и приобретает отрицательные значения.
Окислительно-восстановительные процессы зависят от кислотно-основных условий (рН), в частности, эти условия влияют на степень растворимости продуктов окисления или восстановления, активность микроэлементов и др. (см. рис. 12.1). Поэтому для сопоставления окислительно-восстановительных условий в почвах с различным значением рН пользуются показателем rН2. При значениях rН2 27—30 — условия окислительные, в интервале 27—20 — восстановительные, < 20 — резковосстановительные.
Окислительно-восстановительный потенциал почв весьма неоднороден в пределах почвенного профиля и динамичен во времени. Его изменения связаны с изменением по профилю и по сезонам влажности почв, ее аэрации и содержания кислорода в почвенном воздухе и почвенном растворе. Существенно влияет на ОВП количество органических веществ, выступающих как сильные восстановители. Восстанавливающая способность нарастает в ряду: растительный опад — подстилки — гумусовый горизонт. Внешним проявлением восстановительной обстановки в почвах являются признаки оглеения — появление сизо-серой, зеленоватой окраски в горизонтах с низкими значениями ОВП.
По характеру протекающих окислительно-восстановительных процессов А.И. Перельман выделил три ряда почв:
1) почвы с преобладанием окислительной среды;
2) почвы с восстановительной глеевой обстановкой;
3) почвы с резковосстановительной сероводородной обстановкой.
И.С. Кауричев и Д.С. Орлов дали в соответствии с окислительно-восстановительным режимом и его динамикой более детальную группировку почв.
1.Почвы с абсолютным господством окислительной обстановки — автоморфные почвы степей, полупустынь и пустынь.
2.Почвы с господством окислительных условий при возможном проявлении восстановительных процессов в отдельные влажные годы или сезоны — автоморфные почвы таежно-лесной зоны, влажных субтропиков и широколиственных лесов.
3.Почвы с контрастным окислительно-восстановительным режимом (полугидроморфные почвы различных зон):
а) с развитием сезонных восстановительных процессов в верхних горизонтах;
б) с развитием оглеения в нижних горизонтах;
в) с контрастной сменой окислительной и восстановительной обстановок по всему профилю.
4.Почвы с господством восстановительных условий по всему профилю:
а) с господством глеевой обстановки;
б) с господством сероводородной обстановки.
Окислительно-восстановительный режим в почвах имеет большое значение в почвообразовании и плодородии почв. С ним связаны скорость и направление разложения органических остатков, гумификация и минерализация органических веществ.
Окислительно-восстановительные процессы контролируют фазовые переходы в почвах. Многие химические соединения элементов с переменной зарядностью при смене окислительно-восстановительных условий многократно переходят из твердой фазы в жидкую, из жидкой в газовую и обратно. В почвах гумидных областей с периодическим переувлажнением широко распространены реакции окисления и восстановления железа (Fe3+ 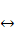 Fe2+) и марганца (Мп4+
Fe2+) и марганца (Мп4+ 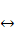 Мп2+). При восстановлении железа и марганца их растворимость в форме углекислых солей, органоминеральных комплексов повышается; они переходят в раствор, могут перемещаться в пределах данного генетического горизонта или выноситься за его пределы. Именно за счет периодических восстановительных процессов образуются отбеленные глеево-элювиальные горизонты. При смене восстановительных условий окислительными при участии специфических микроорганизмов происходит сегрегация гидроксидов железа и марганца и формирование различного рода стяжений и конкреций. Реакции денитрификации и нитрификации (N5+
Мп2+). При восстановлении железа и марганца их растворимость в форме углекислых солей, органоминеральных комплексов повышается; они переходят в раствор, могут перемещаться в пределах данного генетического горизонта или выноситься за его пределы. Именно за счет периодических восстановительных процессов образуются отбеленные глеево-элювиальные горизонты. При смене восстановительных условий окислительными при участии специфических микроорганизмов происходит сегрегация гидроксидов железа и марганца и формирование различного рода стяжений и конкреций. Реакции денитрификации и нитрификации (N5+ 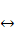 N3+) сопровождаются при восстановлении переходом азота из водорастворимых форм нитратов и нитритов в газовую фазу в форме аммиака NH3, при окислении и нитрификации идет обратный процесс. Те же явления происходят при процессах десульфуризации и сульфуризации — окисление и восстановление серы (S6+
N3+) сопровождаются при восстановлении переходом азота из водорастворимых форм нитратов и нитритов в газовую фазу в форме аммиака NH3, при окислении и нитрификации идет обратный процесс. Те же явления происходят при процессах десульфуризации и сульфуризации — окисление и восстановление серы (S6+ 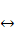 S2-). Шестизарядная сера сульфатов твердой и жидкой фаз почвы переходит в двухзарядную. Последняя может оставаться в твердой фазе в форме сульфидов тяжелых металлов (FeS2 и др.) или переходить в состояние газа в форме сероводорода H2S.
S2-). Шестизарядная сера сульфатов твердой и жидкой фаз почвы переходит в двухзарядную. Последняя может оставаться в твердой фазе в форме сульфидов тяжелых металлов (FeS2 и др.) или переходить в состояние газа в форме сероводорода H2S.
В зависимости от водно-теплового режима, режима кислотно - щелочных условий и биологической активности рассмотренные выше процессы фазовых превращений веществ в почвах приобретают определенный ритм: суточный, сезонный и многолетний.
В своей совокупности они характеризуют современную динамику почв. Изучение динамики почв имеет большое практическое значение, так как является научной основой для регулирования почвенных процессов и управления ими в целях повышения плодородия почв.
| <== предыдущая страница | | | следующая страница ==> |
| ГАЗОВАЯ ФАЗА ПОЧВ. СОСТАВ ПОЧВЕННОГО ВОЗДУХА | | | Факторы структурообразования |
Дата добавления: 2014-05-19; просмотров: 1052; Нарушение авторских прав

Мы поможем в написании ваших работ!