
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Фазовые диаграммы однокомпонентных гетерогенных систем
Однокомпонентная гетерогенная система представляет собой одно вещество, находящееся в разных агрегатных состояниях или полиморфных модификациях. В соответствии с правилом фаз Гиббса, при К = 1
С = 3 - Ф. Учитывая, что по физическому смыслу С ³ 0, очевидно Ф £ 3, т.е. число одновременно существующих фаз в однокомпонентной гетерогенной системе может быть не более трех. При отсутствии полиморфизма это жидкая, твердая и парообразная фазы. Двухфазные равновесия, возможные в такой системе, - это “жидкость - пар”, “твердое тело - пар” и “твердое тело - жидкость”. Каждое из этих равновесий характеризуется определенной взаимосвязью параметров Р и Т, устанавливаемой уравнениями Клапейрона - Клаузиуса для соответствующих процессов: испарения, возгонки и плавления.
Указанные взаимосвязи могут быть установлены и эмпирически, методами физико-химического анализа. Их изображают графически в осях координат “давление-температура”, в виде кривых Р = f(T).
Графическое изображение состояний равновесия фаз при разных Р и Т называется диаграммой состояния, или фазовой диаграммой. Рассмотрим в качестве примера фазовые диаграммы воды и серы.
4.5.1. Фазовая диаграмма воды
Состояние воды исследовано в широком интервале температур и давлений. Известно, что при высоких давлениях лёд может находиться в различных кристаллических модификациях, в зависимости от физических условий (Р и Т). Это явление, названное полиморфизмом, присуще и многим другим веществам. Мы рассмотрим диаграмму состояния воды при невысоких давлениях (до 2200 атм).
Диаграмма имеет три поля фаз:
1) АОВ - поле жидкости,
2) ВОС - поле ненасыщенного пара,
3) АОС - поле твердой фазы.

В любой точке поля система однофазна и бивариантна (К = 1; Ф = 1; С = 2), т.е. в определенных пределах можно менять температуру и давление без изменения количества фаз и их природы. Например, точка 1 соответствует жидкой воде, которая имеет параметры t°1 и Р1.
Если в системе в равновесии находятся две фазы, то К = 1; Ф = 2; С = 1, т.е. система моновариантна. Это значит, что один параметр можно изменять произвольно в некоторых пределах, а другой должен изменяться в зависимости от первого. Эта зависимость выражается кривой Р = f(Т): ОВ - кривая испарения (или конденсации); ОС - кривая возгонки (или сублимации); АО - кривая плавления (или затвердевания). Например, точка 2 характеризует равновесную систему, в которой при температуре t°2 и давлении Р2 находятся в равновесии вода и насыщенный водяной пар. Если Р2 = 1 атм, то t°2 называется нормальной температурой кипения.
Кривая испарения воды ОВ обрывается в критической точке (В) при t° = 374°С и Р = 218 атм. Выше этой точки жидкая и парообразная вода не различимы по свойствам (Д.И. Менделеев, 1860 г.).
Кривая плавления льда АО при давлениях до 2047 атм имеет левый наклон, что соответствует условию DVф.п. < 0 (мольный объем льда > мольного объема воды). Такой лед легче воды, он плавает на воде, поэтому в природных водоемах, не промерзающих до дна, сохраняются живые организмы. При более высоких давлениях лед переходит в более плотные модификации, тогда кривая плавления АО наклонена вправо. Известно семь кристаллических модификаций льда, из них шесть имеют плотность выше плотности жидкой воды. Последняя из них появляется при давлении 21680 атм. Превращение одной формы льда в другую является энантиотропным переходом (см. далее о полиморфизме).
Пунктирная кривая ОЕ (продолжение ОВ) характеризует метастабильное равновесие: переохлажденная вода ↔ насыщенный пар.
Метастабильными называются равновесия, при которых имеются все внешние признаки равновесия фаз, но изобарный потенциал системы не достиг минимального абсолютного значения и может уменьшаться далее.Вода, кристаллизуясь на примесях, перейдет в лед. Точка О - тройная точка. Ее координаты для воды в отсутствие воздуха: Р = 4,579 мм рт. ст., t° = 0,01°C. В присутствии воздуха при 1 атм три фазы находятся в равновесии при 0ºС. В этом случае общее давление равно 1 атм, но парциальное давление водяного пара составляет 4,579 мм рт. ст. Понижение температуры замерзания при этом на 0,01º вызвано двумя причинами: растворимостью воздуха в воде (см. раздел «понижение температуры замерзания растворов») и влиянием общего давления на температуру замерзания жидкостей (повышение общего давления в системе понижает её). Это единственная точка, в которой в равновесии находятся все три фазы: вода, лед и пар. В этой точке система инвариантна: С = 0.
4.5.2. Полиморфизм
Кристаллическая структура вещества определяется не только его химическим составом, но и условиями образования. В природе существует множество примеров, когда в зависимости от условий образования, вещества могут иметь различную структуру кристаллов, т.е. тип решетки, и поэтому различные физические свойства. Это явление называется полиморфизмом. Присутствие той или иной модификации вещества может таким образом характеризовать условия его образования. Полиморфные модификации обозначают греческими буквами a, b, g, d.
Возможны два типа полиморфизма: энантиотропный и монотропный.
Энантиотропия характеризуется обратимым самопроизвольным переходом при определенных Р и Т одной формы в другую. Этот переход сопровождается снижением энергии Гиббса при изменении термодинамических условий (Р,Т). На рис. 4.2 показан энантиотропный переход от фазы a к фазе b при (Р,Т)a↔b. До температуры и давления фазового перехода (левее точки (Р,Т)a↔b) более устойчива a-модификация вещества, т.к. она обладает меньшим запасом свободной энергии G. В точке пересечения кривых Ga=Gb, обе фазы находятся в равновесии. За этой точкой, т.е. при высоких Р и Т, устойчивее b-фаза. Таким образом, a-фаза является низкотемпературной, а b - высокотемпературной модификацией вещества.

|
Энантиотропные превращения характерны для углерода, серы, двуокиси кремния и многих других минералов.

|
Если во всем интервале Р и Т стабильна только одна фаза, то фазовый переход не связан с определенными значениями Р и Т и является необратимым. Такой тип полиморфизма называется монотропией. Более стабильна та фаза, энергия Гиббса которой ниже (на рис. 4.3. b ® a). Монотропные формы в природных условиях встречаются реже; примером может служить система
gFe2O3 ® aFe2O3
маггемит гематит
На фазовой диаграмме полиморфизм вещества характеризуется дополнительными линиями, ограничивающими области существования отдельных полиморфных модификаций.
4.5.3. Фазовая диаграмма серы
В качестве примера рассмотрим диаграмму состояния серы, которая может существовать в виде ромбической или моноклинной серы, т.е. она диморфна. На фазовой диаграмме серы (рис. 4.4), в отличие от диаграммы воды, два поля твердых фаз: область ромбической и область моноклинной серы.
О2О3 - кривая плавления моноклинной серы,
О3А - кривая плавления ромбической серы,
О1О3 - кривая полиморфного превращения: Sромб ↔ Sмонокл
СО1 и О1О2 - кривые возгонки ромбической и моноклинной серы, соответственно,
О2В - кривая испарения жидкой серы.
Пунктирные линии отражают возможность существования метастабильных фаз, которые можно наблюдать при резком изменении температуры:
МО1: [Sромб] ↔ (S)
МО2: {S}↔ (S)
МО3: [Sромб] ↔ {S}

|
Тройные точки соответствуют трехфазным равновесиям: О1 - ромбическая, моноклинная и парообразная сера; О2 - моноклинная, жидкая и парообразная; О3 - ромбическая, моноклинная и жидкая сера. В точке М - метастабильное равновесие трех фаз: ромбической, жидкой и парообразной.
Таким образом, пользуясь фазовой диаграммой, можно определить фазовое состояние вещества в данных условиях или, наоборот, обнаружив ту или иную полиморфную модификацию вещества (например, сплава или минерала), охарактеризовать условия его образования.
4.6. Фазовые диаграммы двухкомпонентных гетерогенных систем с эвтектикой
Рассмотрим систему, состоящую из двух компонентов А и В, которые могут находиться при условии Р = const в виде жидкого расплава компонентов и (или) твердых кристаллов индивидуальных компонентов, не образуя твердых растворов, химических соединений и полиморфных модификаций. Правило фаз Гиббса в этом случае: С = К-Ф+1. Так как С ³ 0, то Ф £ 3, а т.к. Ф ³ 1, то С £ 2. Это значит, что число фаз, которые могут находиться в равновесии, не превышает трех, а вариантность системы не более двух и при К = 2 зависит от числа равновесно сосуществующих фаз по уравнению С = 3 - Ф.
Нагреем смесь компонентов А и В, имеющих определенный состав (например, 90% А и 10% В), до состояния расплава и будем следить за изменением температуры в процессе естественного охлаждения расплава. Получим кривую охлаждения, рис. 4.5, кр. 1. На участке кривой t1-t2 происходит охлаждение расплава. При t2 расплав становится насыщенным одним из компонентов (в данном случае - А) и начинается его кристаллизация, сопровождающаяся выделением тепла. Поэтому термограмма в точке 2 меняет угол наклона (участок t2-t3). Расплав при этом обогащается компонентом В и при t3 становится насыщенным и компонентом В. При этой температуре происходит одновременная кристаллизация компонентов А и В. Состав расплава, при котором компоненты кристаллизуются совместно, называется эвтектическим (от греческого - легкоплавящийся). При температуре эвтектики Ф = 3, С = 0. Кристаллизация эвтектики - изотермический процесс, т.к. состав расплава в процессе кристаллизации эвтектики не меняется. Время кристаллизации эвтектики пропорционально ее содержанию в системе. Чем ближе состав первоначально взятой смеси к эвтектическому, тем это время больше. В точке 3’ заканчивается процесс кристаллизации. Далее идет охлаждение смеси кристаллов. Сплавы, содержащие больше компонента А, называются доэвтектическими.
Их микроструктура состоит из первичных кристаллов А, окруженных затвердевшими мелкими пластинками или зернами микрокристаллов А и В в виде механической смеси.
Возьмем еще одну смесь А и В, но с меньшим относительным содержанием компонента А, чем в первой смеси. Получим такую же кривую охлаждения, но температура начала кристаллизации компонента А (t2/) будет на второй кривой ниже, чем на первой, т.е. расплав станет насыщенным по отношению к А при более низкой температуре.

а) б)
Рис. 4.5. Кривые охлаждения (а) и фазовая диаграмма (б)
двухкомпонентной гетерогенной системы с эвтектикой.
Кристаллизация эвтектики не зависит от первоначального состава смеси, поэтому t3/ = t3. Если компоненты А и В взять в эвтектическом соотношении, то кривая охлаждения имеет вид (кр. 3), подобный кривой охлаждения чистого индивидуального компонента.
Сплавы, содержащие больше компонента В, чем в эвтектике, называются заэвтектическими (кривые 4, 5). Здесь процесс кристаллизации начинается с компонента В и обогащения расплава компонентом А до достижения эвтектического состава. Микроструктура таких твердых фаз обратна - кристаллы В, окруженные эвтектикой. Таким образом, можно установить, какая фаза кристаллизуется первично: кристаллы А или В.
По кривым охлаждения строят фазовую диаграмму (рис. 4.5, б), перенося на нее точки начала кристаллизации компонентов в зависимости от первоначально взятого состава смеси.
Эта зависимость изобразится на диаграмме линиями АЕ и ВЕ, которые вместе образуют линиюликвидуса. Выше этой линии на диаграмме - поле однородного жидкого расплава компонентов А и В; система в этой области однофазна (гомогенна) и би-вариантна. Точка Е характеризует состав эвтектики и температуру ее кристаллизации и называется эвтектическойточкой. Линия ликвидуса характеризует расплавы, насыщенные соответствующим компонентом и, в то же время, - температуру кристаллизации компонента в зависимости от состава расплава. Горизонталь CD, проходящая через точку эвтектики Е, называется линиейсолидуса (от греч. solidus - твердый), или эвтектической линией. Ниже линии эвтектики в системе существуют только твердые фазы - механическая смесь кристаллов А и В. Таким образом, линии ликвидуса и солидуса делят диаграмму на четыре фазовых поля:
I - поле гомогенной жидкой фазы (расплав);
II - поле двухфазного равновесия кристаллов А и расплава компонентов А и В;
III - поле двухфазного равновесия кристаллов В и расплава компонентов А и В;
IV - поле двух твердых фаз (кристаллов А и кристаллов В).
В соответствии с правилом фаз Гиббса, вариантность системы в любой точке на линии ликвидуса: С = 1, (К = 2; Ф = 2). Это означает, что только один параметр - либо температуру, либо состав - можно изменить произвольно (в некоторых пределах) так, чтобы число и характер фаз при этом не изменились. В точке эвтектики (Е) система безвариантна, С = 0, (К = 2; Ф = 3).
Это означает, что малейшее изменение любого параметра (состава системы или температуры) приведет к нарушению равновесия, и в системе произойдет изменение числа фаз или их природы.
В точке А (или В) - система однокомпонентна, двухфазна (кристаллы компонента и его расплав) и инвариантна. Инвариантность системы в точках А, В и Е объясняет постоянство температуры в процессе кристаллизации (или плавления) чистого вещества и эвтектики.
Точное положение точки эвтектики на диаграмме довольно сложно установить при изображении линии ликвидуса по экспериментальным данным.
Решить эту проблему можно, используя графическое построение - так называемый треугольникТаммана. Для этого на линии солидуса из точек, соответствующих составам смесей, взятых для снятия кривых охлаждения, наносят отрезки, соответствующие продолжительности температурных остановок в процессе кристаллизации эвтектики (см. рис. 4.5, а, кривые охлаждения). Отрезки откладывают перпендикулярно линии солидуса. Концы отрезков соединяют (треугольник CDF на рис. 4.5, б).
Для нахождения состава равновесных фаз, например, в точке М, проводят ноду kn через точку М до пересечения с линиями, ограничивающими данную гетерогенную область, параллельно оси абсцисс. Составы равновесных фаз определяют точки k и n: точка n - состав твердой фазы (кристаллы В), а точка k - состав расплава при данной температуре. Любая другая точка, лежащая на этой же ноде, будет соответствовать такому же составу фаз, как и точка М, изменятся лишь их количества. Определить количество равновесных фаз можно по правилурычага. Например, для точки М отношение количества расплава к количеству кристаллов В равно отношению отрезков Mn / kM.
Более сложный вид имеет диаграмма с эвтектикой при наличии полиморфизма у одного из компонентов. Допустим, например, что компонент А имеет две полиморфные модификации b и a. Если температура полиморфного превращения tb ® a выше температуры плавления эвтектики, диаграмма имеет вид, изображенный на рис. 4.6. Кривая охлаждения для точки М (рис. 4.6, б) имеет два изотермических участка: переход b в a-модификацию и кристаллизация эвтектики. Поле I соответствует фазе b и расплаву, а поле II - фазе a и расплаву. Ниже линии солидуса - механическая смесь кристаллов В и a-А.

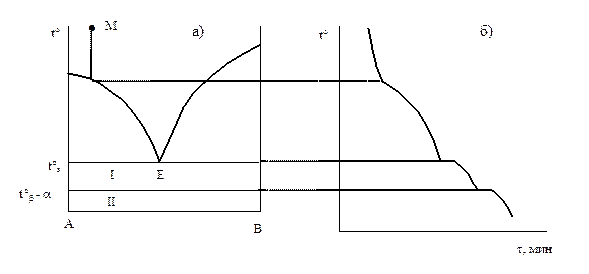 Рис. 4.6., 4.7. Фазовые диаграммы с эвтектикой при наличии полиморфизма компонента: t°b®a > tэ, Рис.4.6. и t°b®a < tэ , Рис. 4.7
Рис. 4.6., 4.7. Фазовые диаграммы с эвтектикой при наличии полиморфизма компонента: t°b®a > tэ, Рис.4.6. и t°b®a < tэ , Рис. 4.7
Если температура полиморфного перехода ниже температуры кристаллизации эвтектики, то диаграмма отличается от изображенной на рис. 4.5 наличием в области твердых фаз дополнительной линии t°b®a, параллельной линии эвтектики, которая разделяет области существования кристаллов А в b (обл. I) и a (обл. II)-модификации, рис. 4.7. Горизонтальные линии, соединяющие отдельные участки на диаграммах а) и кривых охлаждения б), имеют вспомогательный характер, указывая на соответствие температур.
Многие металлы образуют между собой сплавы эвтектического типа. Это, например, алюминий и олово, медь и кадмий, серебро и таллий, серебро и висмут, кадмий и свинец.
4.7. Диаграммы с конгруэнтно и инконгруэнтно плавящимися химическими соединениями
Если компоненты А и В образуют между собой химическое соединение АхВу, которое при плавлении не разлагается (т.е. плавится конгруэнтно), то фазовая диаграмма представляет собой фактически две диаграммы с эвтектикой (рис. 4.8). В качестве одного из компонентов в каждой из них выступает химическое соединение. Точка его плавления (точка D) называется дистектической точкой. Левая часть диаграммы представляет собой эвтектическую систему А-АхВу; правая часть - систему компонентов АхВу и В. Две эвтектические точки Е1 и Е2 характеризуют механические смеси кристаллов двух соответствующих компонентов в равновесии с их расплавами.
Линия ликвидуса Е1D характеризует температуру кристаллизации химического соединения из расплава А + АхВу (расплав 1), а линия ликвидуса Е2D - кристаллизацию этого же компонента АхВу, но из расплава 2, т.е. В + АхВу. Граница полей двух расплавов показана пунктиром.
Если при плавлении химическое соединение АхВу частично диссоциирует на компоненты А и В, то линия ликвидуса вблизи точки дистектики имеет более округлую форму. При наличии нескольких химических соединений, образуемых компонентами А и В, каждому из них соответствует своя дистектическая точка, а диаграмма разбивается на соответствующее количество эвтектических систем.
В качестве примера на рис. 4.9. приведена фазовая диаграмма двойной системы волластонит (СаSiO3) - алюминат кальция (CaAl2O4) с химическим соединением Ca2Al2SiO7 (геленит). Геленит плавится при 1595°С без разложения. Волластонит имеет две полиморфные модификации, претерпевая структурную перестройку при 1125°С.

Рис. 4.8. Фазовая диаграмма двухкомпонентной гетерогенной системы с конгруэнтно плавящимся химическим соединением

Рис. 4.9. Двойная система волластонит - алюминат кальция
Поэтому в нижней левой части диаграммы имеется два поля твердых фаз: низкотемпературная b-модификация волластонита сосуществует с геленитом до температуры полиморфного перехода tb®a=1125°C и высокотемпературная a-модификация с геленитом - выше этой температуры.
В природе существует много систем, в которых химическое соединение разлагается при плавлении (т.е. плавится инконгруэнтно). В этом случае состав образующегося расплава отличен от состава твердой фазы, из которой он образуется. Диаграмма такого типа приведена на рис. 4.10. Плавление химического соединения можно представить уравнением АхВу ® L + B, где L - расплав. Состав расплава L при плавлении АхВу будет соответствовать точке Р на диаграмме. Эта точка называется перитектической, или реакционной точкой, а линия РС - перитектической, или реакционной горизонталью.
Выше линии РС химическое соединение не существует, линия РМС приведена только для оценки положения точки М относительно вертикали, характеризующей состав химического соединения. На правой части рисунка приведена кривая охлаждения, соответствующая фигуративной точке N на диаграмме. Состав расплава в точке N находится между Р и АхВу, что видно из диаграммы. Вертикальная пунктирная линия, проведенная из точки N до оси состава, называется линией постоянного состава, или изоплетой. Она помогает определить порядок выделения фаз при охлаждении или нагревании системы.
 Рис. 4.10. Фазовая диаграмма бинарной системы с инконгруэнтно плавящимся химическим соединением и кривая охлаждения.
Рис. 4.10. Фазовая диаграмма бинарной системы с инконгруэнтно плавящимся химическим соединением и кривая охлаждения.
На участке N-1 расплав компонентов А и В охлаждается. В точке 1 расплав становится насыщенным относительно компонента В и на участке 1-2 происходит его кристаллизация. В точке 2 на кривой достигается температура перитектики и происходит перитектическая реакция
B + L(p) ® AxBy (4.15)
Этому процессу на кривой охлаждения соответствует участок 2-3. Кристаллы компонента В и часть жидкого расплава образуют при этих условиях химическое соединение. Этот процесс инвариантен, т.е. число степеней свободы на участке 2-3 равно нулю, т.к. в реакции (4.15) участвуют 3 фазы. После завершения перитектической реакции (точка 3) в системе остается две фазы - неизрасходованная часть расплава и кристаллы АхВу. Система становится моновариантной и начинается дальнейшее падение температуры (участок 3-4 на кривой охлаждения). При этом из расплава кристаллизуется химическое соединение АхВу, а состав расплава меняется по линии ликвидуса от точки Р до точки эвтектики Е. В этой точке в эвтектической пропорции кристаллизуются химическое соединение АхВу и компонент А до полного затвердевания расплава.
На рис. 4.11 в качестве примера фазовой диаграммы с инконгруэнтно плавящимся химическим соединением приведена бинарная система лейцит (KAlSi2O6) - кремнезем (SiO2). При охлаждении жидкого расплава, обогащенного лейцитом (левая часть диаграммы), сначала наблюдается кристаллизация лейцита (участок МС). Падение температуры и обогащение расплава компонентом SiO2 приводит к точке С, соответствующей перитектической реакции образования калиевого полевого шпата (ортоклаза) - KAlSi3O8 по уравнению:
жидкость+ лейцит ® калиевый полевой шпат
Реакция идет до полного расходования лейцита, при постоянной температуре. После завершения перитектической реакции (точка С) оставшаяся жидкость охлаждается, из нее дополнительно кристаллизуется полевой шпат (участок СЕ), а при достижении эвтектического состава жидкости (точка Е) при температуре эвтектики кристаллизуются две твердые фазы: тридимит и полевой шпат, - до полного затвердевания расплава.

Рис. 4.11. Бинарная система лейцит-кремнезем
Кремнезем в пределах температур, показанных на диаграмме, существует в двух различных структурных формах, или полиморфных модификациях. Диаграмма показывает, что при температуре 1470°С происходит полиморфное превращение кристобалита в тридимит. Однако в действительности этот процесс протекает очень медленно, и кристобалит часто присутствует как метастабильная фаза в условиях комнатных температур. При температуре ниже 1470°С кремнезем должен кристаллизоваться в виде тридимита. Хотя на диаграмме и не показано, обе эти полиморфные модификации, прежде чем достичь комнатной температуры, должны перейти в кварц.
| <== предыдущая страница | | | следующая страница ==> |
| Однокомпонентные гетерогенные системы. Уравнение Клапейрона - Клаузиуса | | | Твердые растворы. Понятие об изоморфизме |
Дата добавления: 2014-10-02; просмотров: 749; Нарушение авторских прав

Мы поможем в написании ваших работ!