
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Перекисное окисление липидов в норме и патологии
Учебно-методическое пособие
Ростов-на-Дону
УДК: 616.24-008.9
ББК: 54.12
Утверждено на заседании Центральной методической комиссии
Государственного бюджетного образовательного учреждения Высшего профессионального образования «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
Протокол №8от 2012 г.
Шепелев А.П., Шестопалов А.В., Ставиский И.М.Перекисное окисление липидов /учебно-методическое пособие / Шепелев А.П., Шестопалов А.В., Ставиский И.М.2007. – Ростов-на-Дону: Государственное бюджетное образовательное учреждение Высшего профессионального образования «Ростовский государственный медицинский
университет Министерства здравоохранения и социального развития Российской Федерации– 2012. – 46 с.
Составлено на кафедре общей и клинической биохимии №2Государственного бюджетного образовательного учреждения Высшего профессионального образования «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
д.м.н., профессором Шепелевым А.П., д.м.н. Шестопаловым А.В. – заведующим
кафедрой общей и клинической биохимии №2 и к.м.н., доцентом Стависким И.М.
Представлены особенности метаболических процессов образования, функциональных эффектов и роли свободных радикалов в норме и в развитии патологических процессов в организме человека.
Рецензенты:
Доктор биологических наук, профессор, директор НИИ биологии Южного Федерального университета Шкурат Т.П.
Кандидат медицинских наукнаук, ассистент кафедры гематологии и трансфузиологии с курсом клинической лабораторной диагностики ФПК и ППСГосударственного бюджетного образовательного учреждения Высшего профессионального образования «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации» Волкова М.С.
© Государственное бюджетное образовательное учреждение Высшего профессионального образования «Ростовский государственный медицинский
университет Министерства здравоохранения и социального развития Российской Федерации»
© А.П.Шепелев, А.В.Шестопалов, И.М.Ставиский.
СПИСОК СОКРАЩЕНИЙ
АО – система антиоксидантной защиты
АОС –антиоксидантная система.
АФК –активные формы кислорода
ЛТ - лейкотриен
5-ЛОГ – 5-липоксигеназа
МПО – миелопероксидаза
МДА – малоновый диальдегид
МРСА -
МТ – металлотионеины.
5-НРЕТЕ - 5-гидроксипероксиэйкозатетраеновая кислота
ONOO- - пероксинитрил
ПГ - простагландин
ПОЛ – перекисное окисление липидов
Протеинкиназа G – фермент катализирует фосфорилирование киназы легких цепей
миозина
СОД – супероксиддисмутаза.
СРО – свободно радикальное окисление
СРОЛ – свободно-радикальное окисление липидов
ТХ - тромбоксан
ФЭА – фосфатидилэтаноламин
ЦОГ – циклоксигеназа
ЦП – церулоплазмин.
ЦПЭ – цепь переноса электронов
цГМФ – циклическая форма гуанозимонофосфата
ЭПО – пероксидаза эозинофилов.
GSNO - нитрозоглютатион
GSH–восстановленный глютатион
ВВЕДЕНИЕ
Перекисное окисление липидов (ПОЛ) относится к типичным свободнорадикальным реакциям.
Свободнорадикальное окисление (СРО) с одной стороны, участвует в регуляции жизненных процессов и обеспечивает защитные и компенсаторные реакции организма на действие повреждающих факторов различной этиологии, с другой стороны, СРО лежит в основе старения организма и является одним из главных механизмов гибели клеток.
СРО в организме противостоит мощная система антиоксидантов (АО). Благодаря сбалансированности систем СРО и АО, все свободнорадикальные реакции находятся под контролем АО и легко регулируются, что позволяет организму в зависимости от конкретных условий использовать СРО для обеспечения многих жизненно важных процессов. Однако нарушение баланса, обусловленное стимуляцией СРО и снижением активности АО, может привести к накоплению продуктов СРО и в силу их высокой реакционной способности вызвать изменение структуры нуклеопротеидов, белков, липидов и других важнейших соединений, что чревато развитием в организме патологических процессов. Нарушение баланса СРО и АО называется окислительным стрессом и лежит в основе развития многих заболеваний как инфекционной, так и неинфекционной природы. СРО протекает, как правило, с обязательным участием кислорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода.
O₂ 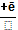 O₂
O₂ 
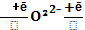 [ O2
[ O2  +
+ 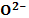 ]+ ē 2
]+ ē 2 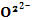
+H⁺+2H⁺ 3H+ 4H⁺
← ←
HO₂H₂O₂HO  2H₂O
2H₂O
Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует, таким образом, цепные реакции окисления.
Различают неферментативное и ферментативное образованиеАФК.
При неферментативном механизме образования АФК в основе процесса лежат следующие реакции:
1.O₂ 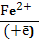 O2
O2  2. O₂
2. O₂  + H⁺HO₂
+ H⁺HO₂ 
3. HO₂ 
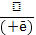 HO₂⁻ 4.HO₂⁻ + H⁺H₂O₂
HO₂⁻ 4.HO₂⁻ + H⁺H₂O₂
5. H₂O₂ 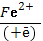 HO
HO  + HO⁻ 6.H₂O₂ + O₂
+ HO⁻ 6.H₂O₂ + O₂  HO
HO  + HO⁻ + O₂
+ HO⁻ + O₂
К активным формам кислорода (АФК) относят следующие кислородсодержащие радикалы : ОН• - гидроксильный радикал; О2•- супероксидный анион-радикал, NO•- оксинитрил,а также Н2О2 - пероксид водородаи НОСl -гипохлорная кислота. Строго говоря, последние два соединения к свободным радикалам не относятся, однако из перекиси водорода в присутствии атомов восстановленного железа F2+ и (или) О2•очень быстро образуется одна из наиболее активных форм кислорода – гидроксильный радикал:
Н2О2 + Fe2+→HO• + ОН- + Fe3+ –реакция Фентона
Н2О2 + О2• Fe++ HO• + ОН-+ О2 -реакция Хабера-Вейса
HOCl + О2• → HO• +Cl• + О2
Одним из основных источников образования АФК является митохондриальная цепь переноса электронов (ЦПЭ).
Утечка электронов из ЦПЭ митохондрий и микросом и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток.
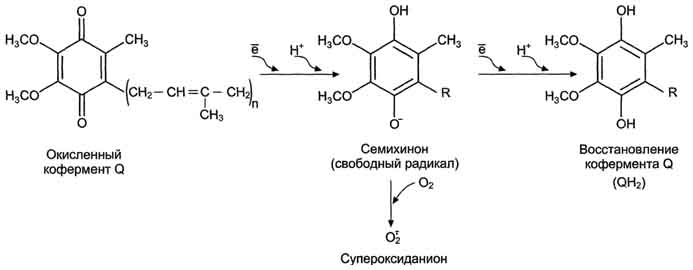
Рис. 1. Реакции образования АФК в дыхательной цепи.
Кофермент Q в ЦПЭ митохондрий принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона - KoQH•. При изменении условий функционирования дыхательной цепи (например, при гипоксии) в ней также возможно одноэлектронное восстановлениекислорода, объясняющееся тем, что его сродство к убихинону выше, чем к цитохромоксидазе. Эти процессы приводят к образованию супероксидного анион-радикала кислорода.
Супероксид-анион радикал является высокореакционным соединением, которое вследствие высокой гидрофильности и наличия заряда не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей.Этот радикал может образовываться и под влиянием ультрафиолетовых лучей, а также путем взаимодействия кислорода с ионамиметаллов переменной валентности (чаще всего с железом) или в ходе спонтанного окисления некоторых соединений, например дофамина. Наконец, он может продуцироваться в клетках и такими ферментами, как ксантиноксидаза или НАДФН-оксидаза.
Он способен активировать NO-синтазу, которая образует в тканяхNO-радикал, обладающий свойствами вторичного посредника (активирует растворимую гуанилатциклазу, продукт которой – цГМФ – проявляет вазодилататорные свойства). С другой стороны, супероксид-анион способен снижать содержание NO-радикала, превращая его в пероксинитрит - ONOOH.
Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион 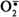 , который, в свою очередь, может превращаться в другие активные формы кислорода:
, который, в свою очередь, может превращаться в другие активные формы кислорода:
Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода - гидроксильного радикала (ОН•) по следующей реакции:
Fe2+ + Н2О2 → Fe3+ + ОН- + ОН•.
Наличие в клетках Fe2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.
Ферментативные пути образования активных форм кислорода
Кроме неферментативного пути образования АФК в организме человека и животных возможно и ферментативное образование супероксидного анион-радикала и перекиси водорода при окислении органических субстратов различными оксидазами. Примерами могут служить супероксиддисмутаза, трансформирующая супероксидные анион-радикалы в перекись водорода и ксантиноксидаза, образующая супероксидный анион-радикал при окислении ксантина в мочевую кислоту.
В клетках животных организмов ферменты, образующие перекись водорода, локализованы преимущественно в пероксисомах. Кроме ксантиноксидазы в пероксисомах обнаружены уратоксидаза, оксидазы аминокислот, гликолатоксидаза, оксидаза α-гидрооксикислот и ряд других ферментов. Все ферменты пероксисом являются индуцибельными, их активность значительно возрастает при повышении в организме соответствующих субстратов.
Микросомальные монооксигеназы.В микросомах образование супероксидного антион-радикала осуществляется с участием цитохрома Р-450 и цитохрома b5.
Наиболее многочисленными реакциями являются монооксигеназные реакции, протекающие с участием цитохрома Р450. Монооксигеназы участвуют в синтезе и метаболизме многих физиологически важных соединений, таких как стероидные гормоны, желчные кислоты, витамины, простагландины и др. Кроме этого, важной функцией микросомальных монооксигеназ является детоксикация гидрофобных ксенобиотиков посредством гидроксилирования. НАДФН-цитохром-Р-450-зависимая система гидроксилирования ксенобиотиков содержится, главным образом, в эндоплазматическом ретикулуме большинства органов, за исключением саркоплазматических ретикулумов миокарда и скелетных мышц.
Наряду с монооксигеназной активностью, Р450 может проявлять и оксидазную актиность, генерируя супероксидный анион-радикал, перекись водорода и гидроксильный радикал.
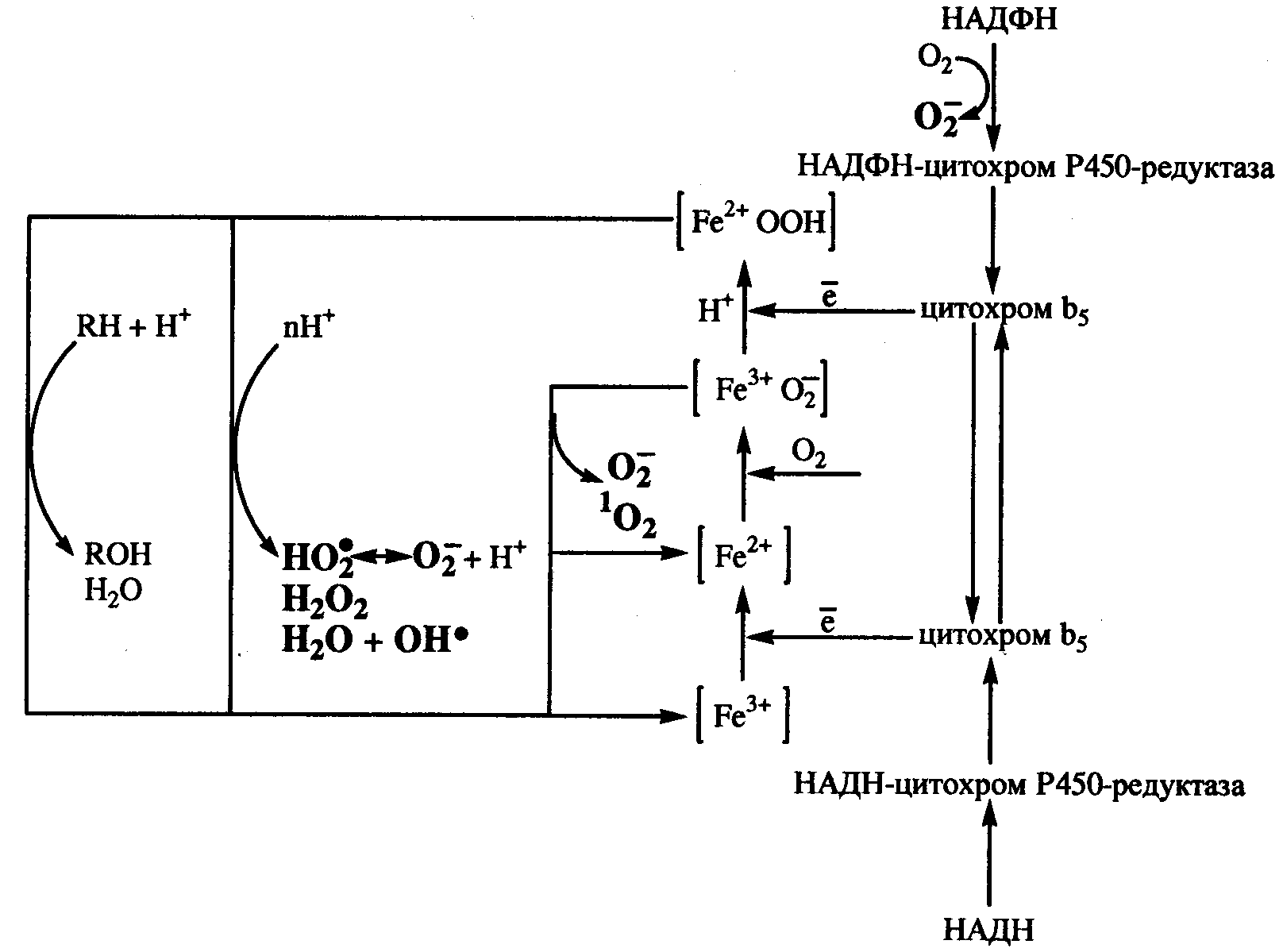
Рис.2. Образование активных форм кислорода в процессе микросомальных Р45О – зависимых монооксигеназных реакций (по Е.Б.Меньщиковой с соавт.,2006)
При биотрансформации гидрофобных веществ продукция супероксидных анионов может резко возрастать и возникает реальная угроза токсического поражения организма. Этому противостоит мощная система молекулярных антиоксидантных механизмов, обеспечивающих поддержание гомеостаза.
Ксантиноксидоредуктаза.В нормальных условиях ксантиноксидоредуктаза находится в дегидрогеназной форме и катализирует окисление ксантина с участием НАД в качестве акцептора электронов с образованием мочевой кислоты. Однако при некоторых патологических состояниях, в частности при ишемии органов, в результате активирования внутриклеточных кальцийзависимых протеаз ксантиндегидрогеназа подвергается протеолизу с отщеплением короткого пептида и необратимо превращается оксидазную форму. Акцептором электронов в оксидазной реакции выступает кислород (рис. 3):
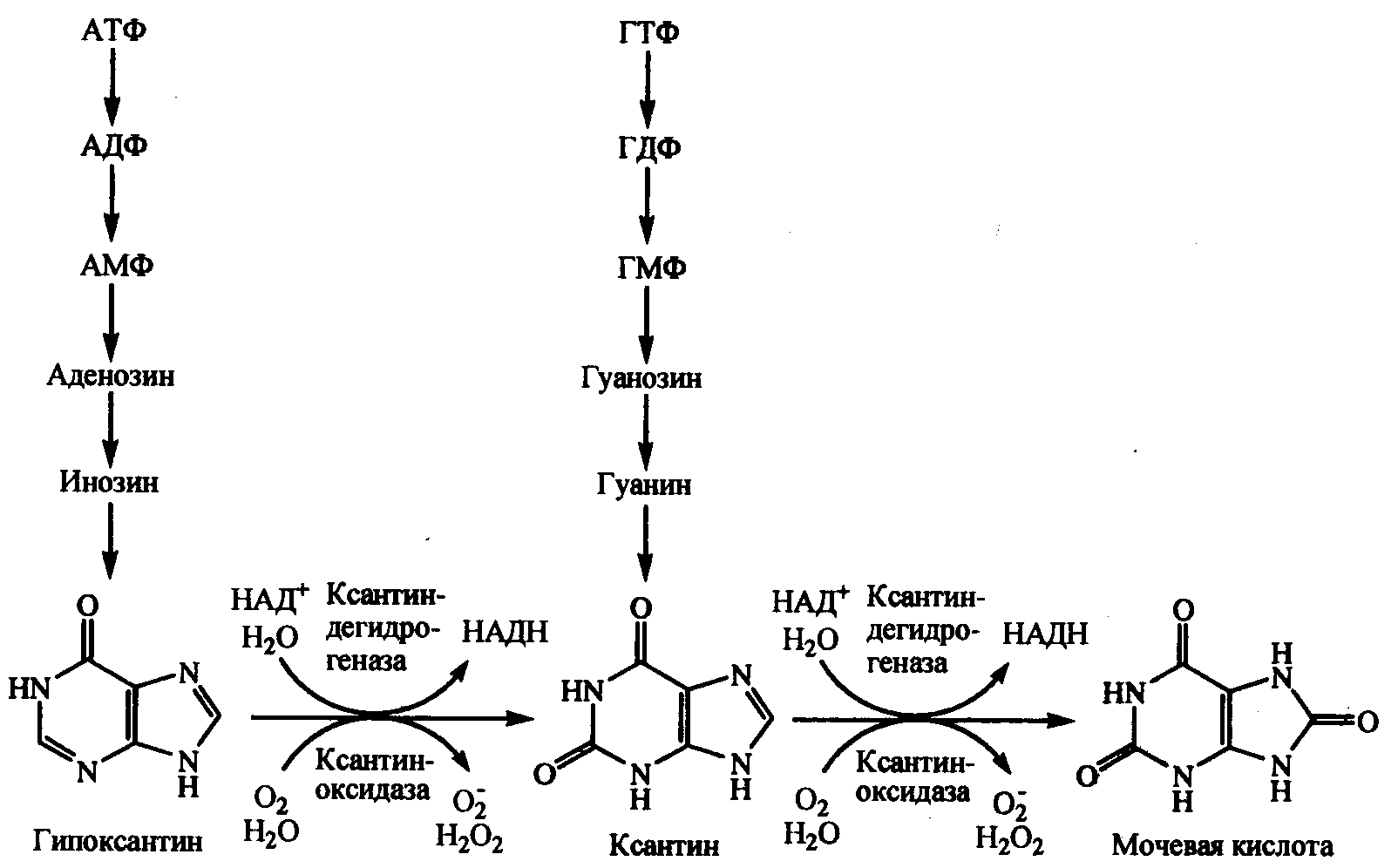
Рис.3. Образование мочевой кислоты и супероксидного анион-радикала при окислении пуринов в ксантиноксидоредуктазной реакции.
В организме человека ксантиноксидоредуктаза представлена в наибольшем количестве в клетках печени и тонкого кишечника.
НАДФ-оксидаза. Наряду с ксантиноксидазой мощным продуцентом супероксидного анион-радикала является НАДФН-оксидаза фагоцитирующих клеток. НАДФН-оксидаза представляет собой мультикомпонентную систему, состоящую из цитозольных и мембраносвязанных ферментов. При стимуляции фагоцитов происходит быстрая самосборка этих цитозольных и мембранных компонентов в НАДФН-оксидазный комплекс, осуществляющий перенос электронов с цитозольного НАДФ на молекулярный кислород с образованием супероксидного анион-радикала
Генерация супероксидного анион-радикала при активации фагоцитов играет важную роль в реализации их микробицидного, цитотоксического и иммунорегуляторного действия. В результате дисмутации супероксидный анион-радикал образует перекись водорода, которая используется миелопероксидазой фагоцитов для производства гипохлорит-ионов, обладающих высокой реакционной способностью; перекись водорода при взаимодействии с ионами двухвалентого железа дает гидроксильный радикал, а при реакции с оксидом азота образуется пероксинитрит. Таким образом, супероксидный анион-радикал, генерируемый активными фагоцитами, служит основой для образования других активных свободных радикалов, обеспецивающих микробицидное действие.
NО-синтаза. Ферментативным путем образуется и азотсодержащий радикал кислорода - оксид азота (NO*). Синтез оксида азота в организме человека и животных происходит при ферментативном окислении L-аргинина. Процесс является довольно сложным и катализируется специфическими ферментами NO-синтазами (NOS), кофакторами выступают НАДФН, тетрагидробиопротеин, флавинадениндинуклетотид и флавинмононуклеотид.
Оксид азота обладает широким спектром биологического действия:
1.Играет ключевую роль в регуляции сосудистого тонуса.
2.Расслабляет гладкую мускулатуру.
3.Предотвращает агрегацию тромбоцитов и адгезию нейтрофилов к эндотелию.
4.Является важным нейромедиатором.
5.Обладает цитотоксической и микробицидной активностью.
Неслучайно поэтому оксид азота называют «сигнальной молекулой жизни».
Действие оксида азота на сердечно-сосудистую систему обусловлено в основном активацией гуанилатциклазы, образованием цГМФ и активацией протеинкиназы G. В гладкомышечных клетках протеинкиназа G фосфорилирует киназу легких цепей миозина, снижая ее сродство к Ca2+- кальмодулиновому комплексу. Дефосфорилирование легких цепей миозина препятствует образованию актомиозиновых мостиков, уменьшая силу сокращения гладкомышечных клеток и сосудистый тонус.
При стимуляции рецепторов эндотелиальных клеток некоторыми медиаторами или гормонами происходит повышение внутриклеточной концентрации ионов кальция, активируется эндотелиальнаяNO-синтаза, образующийся оксид азота диффундирует в гладкомышечные клетки и вызывает вазодилятацию. Вазодилятация при физической нагрузке, частично, объясняется тем, что увеличение скорости кровотока повышает концентрацию ионов кальция в эндотелиальных клетках, следовательно, и активность NO-синтазы.
Снижение или отсутствие эндогенной продукции оксида азота при эндотелиальной дисфункции считают одной из ключевых причин развития ишемических и атеросклеротических изменений в коронарных сосудах.
В качестве необходимого компонента оксид азота участвует:
1. В работе желудочно-кишечного тракта и мочеполовой системы.
2. Функционировании секреторных клеток и тканей, в частности, в выработке
инсулина.
3.В работе органов дыхания.
4. Вобеспечении нормального состояния кожного покрова.
5.В развитии болевой реакции.
6.В регуляциитромбообразования и адгезии тромбоцитов на поверхности сосудов в
качестве ингибирующего фактора.
Установлен факт функционирования оксида азота в работе репродуктивной системы животных и человека.
В центральной нервной системе оксид азота обеспечивает выделение нейромедиаторов, участвует в синаптической передаче и формировании длительно функционирующих связей между нейронами – постсинаптической потенциации, лежащей в основе памяти, обучения и творческой деятельности человека в целом. Регуляторные функции оксида азота проявляются при его чрезвычайно низкой концентрации, составляющей всего лишь микро- и даже наномоли на 1 кг ткани. При больших концентрациях оксида азота проявляется цитотоксическое действие, что лежит в основе клеточного иммунитета, обеспечивающего его действие на клетки – мишени. При повышенной генерации оксида азота, которое обнаруживается при разнообразных патологиях в гладкой мускулатуре сосудов, миокарде, нервной ткани и ткани секреторных органов, токсическое действие азота приводит к существенным негативным последствиям. Так, усиленный синтез оксида азота в сосудах при бактериальных инфекциях может вызвать эндосептический шок, обусловленный резким снижением периферического сопротивления кровеносных сосудов из-за их значительного расслабления и быстрым падением давления крови. Эндотоксин стимулирует активность индуцибельной NO-синтазы. Интенсивная и продолжительная активация индуцибельной синтазы оксида азота при септическом шоке сопровождается мощным усилением биосинтеза оксида азота, который играет двойственную роль в патогенезе септического шока. Так, он оказывает защитный антибактериальный эффект, но в то же время проявляет и неблагоприятное действие, включая устойчивую вазодилятацию, гипотензию и гипореактивность по отношению к сосудосуживающим агентам.
Образование оксида азота с участием индуцибельнойNO-синтазы в макрофагах, лимфоцитах и нейтрофилах играет важную роль в иммунных реакциях и в развитии воспаления. Повышение уровня оксида азота в крови больных с выраженной общей воспалительной реакцией играет важную роль в высвобождении интерлейкина-1, интерлейкина-6, интерлейкина-8 и других индукторов воспаления. Бактерицидная, фунгицидная, антипаразитарная, противовирусная и противоопухолевая активности макрофагов могут быть частично обусловлены интенсивной секрецией оксида азота.
NO• нестабилен в физиологических средах, однако он может взаимодействовать с глутатионом с образованием нитрозоглутатиона (GSNO), который значительно более устойчив. GSNO может транспортироваться из клетки в клетку, сохраняться в клетках и выступать в качестве донора NO-радикалов. Так как в клетках млекопитающих концентрации GSH могут достигать 10 мМ, то GSNO может служить одним из главных либераторов NO• в организме и вносить определенный вклад в цитотоксическое действие NO• в отношении внутриклеточных микроорганизмов, в том числе M. Tuberculosis.
Оксид азота при взаимодействии с супероксидным анион-радикалом образует пероксинитрит – ONOO-, обладающий цитотоксическим и бактерицидным действием. В свою очередь, пероксинитрит под влиянием двухвалентного иона железа превращается в диоксид азота с образованием гидроксильного радикала (реакция А.Н.Осипова). В общем, синтез и окислительные превращения оксида азота могут быть представлены в виде следующей схемы:
Аргинин → NO* + О2* → ONOO - → NO2 + HO*
Оксид азота способен стимулировать ангиогенез, что чрезвычайно важно в условиях ишемии миокарда. Оксид азота играет существенную роль в модуляции апоптоза клеток интимы как физиологического процесса. Усиление этого явления ассоциировано с атерогенезом, который замедляется при восстановлении нормального уровня оксида азота. Оксид азота параллельно препятствует адгезии и миграции моноцитов в сосудистую стенку, являясь, таким образом, одним из ведущих антисклеротических факторов. Описанные функции рассматриваются как цитопротекторные, особенно на фоне имеющихся кардиоваскулярных нарушений.
В физиологических концентрациях оксид азота выступает преимущественно в роли антиоксиданта, который тормозит развитие радикальных окислительных реакций, связывая свободные и входящие в состав гема ионы двухвалентного железа и ингибируя разложение перекиси водорода и гидроперекисей. Кроме этого, взаимодействуя с гидроперекисными радикалами (ROO* + NO* → ROONO), оксид азота ингибирует развитие цепей свободнорадикальных реакций.
Таким образом, оксид азота как активный биологический агент может оказывать как положительное (регуляторное) действие, так и существенное негативное патологическое действие, лежащих в основе развития многих заболеваний человека.
В практическом здравоохранении широко используются нитратсодержащие противоангинальные препараты (нитроглицерин, нитросорбид, амилнитрит и др.), лечебный эффект которых обосновано связывают с их способностью высвобождать в организме оксид азота. Нитроглицерин входит в клетку, где он трансформируется тиолзависимой ферментной системой в оксид азота и близкородственные соединения. Продолжительное введение нитроглицерина индуцирует состояние толерантности. Показано, что нитроглицерин быстро истощает сульфгидрильные группы, необходимые для его биотрансформации в оксид азота. Введение N-ацетилцистеина обращает толерантность нитроглицерина.
Миелопероксидаза. При взаимодействии перекиси водорода с ионами хлора образуется высокоактиный гипохлорит ион. Реакция катализируется миелопероксидазой (МПО), которая локализуется в азурофильных гранулах нейтрофильных гранулоцитов. МПО (Н2О2-оксидоредуктаза) представляет собой гемопротеин, состоящий из двух тяжелых (β) и двух легких (α) субъединиц; β-субъединицы соединены одной дисульфидной связью и содержат 2 ковалентно связанные железосодержащие простетические группы.
Первичным продуктом, образующимся при окислении хлоридов миелоперксидазой, является хлорноватистая (гипохлорная) кислота ((HOCl), которая находится в равновесии с гипохлорит-ионом (OCl-):
Н2О2 + Cl−МПОHOCl + OH-
HOCl → H+ + OCl-
Стимуляция фагоцитоза, сопровождающаяся дегрануляцией нейтрофилов, приводит к высвобождению МПО и образованию гипохлорит иона, являющего важным микробицидным фактором полиморфноядерных лейкоцитов. Гипохлорит-ион является сильным окислителем и поэтому накапливается и хранится в нейтрофилах в специальных гранулах, мембрана которых предохраняет клеточные структуры от повреждающего воздействия гипохлорит-иона.
Гипогалоиды представляют собой мощные токсины, чрезвычайно реакционоспособные в химическом отношении и взаимодействуют с органическими молекулами, либо галогенируя их, либо окисляя. При взаимодействии с гипогалоидами в первую очередь окисляются сульфгидрильные и тиоэфирные группы белков, поэтому наличие в среде белковых молекул, содержащих подобные группы, существенно снижает цитотоксическое действие гипогалоидов. Так, основным сывороточным ингибитором гипогалоидов считается альбумин.
Гипогалоиды способны окислять железосерные центры и гемовые группы ферментов. Гипогалоиды могут как индуцировать, так и ингибировать процессы перекисного окисления липидов. Индукция ПОЛ может быть вызвана освобождением железа в каталитически активной форме (Fe2+), одновременно гипохлорит может взаимодействовать с Fe2+ с образованием гидроксильного радикала:
Fe2+ + OCl- + H+ Fe3+ + OH* + Cl-
Установлено, что гипохлорит-ион легко проникает в поверхностный фосфолипидный слой циркулирующих в крови липопротеидов низкой плотности и, вызывая их окисление, индуцирует тем самым эффективный захват окисленных липопротеинов макрофагами через «скэвэнджер»-рецепторы.
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
Реакции перекисного окисления липидов являются свободнорадикальными и постоянно происходят в организме. Наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие изолированные двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал. ПОЛ характеризуют цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее развитие перекисного окисления.
Зарождение цепи СРОЛ начинается с образования свободного радикального соединения. Этот радикал образуется в акте одноэлектронного окисления при отрыве гидроксильным радикалом атома водорода от молекулы ненасыщенной жирной кислоты. Наименьшую энергию нужно затратить при отрыве водородного атома от углерода, находящегося в альфа- положении по отношению к двойной связи. Олеиновая, линолевая, линоленовая и арахидоновая кислоты содержат соответственно 1,2,3,4, таких альфа углеродных атома:
αα
СН 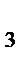 - (СН
- (СН  )
) 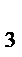 - СН
- СН  – СН = СН – СН
– СН = СН – СН  – СН = СН – СН
– СН = СН – СН  – (СН
– (СН  )
) 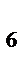 – СООН
– СООН
Этим и объясняется увеличение реакционной способности ненасыщенных жирных кислот с увеличением числа двойных связей.
Свободнорадикальная атака НО• альфа- углеродного атома, сопровождающаяся отрывом от него одного атома водорода, приводит к появлению свободного π- электрона в системе сопряженных двойных связей:
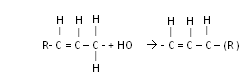
Стадии перекисного окисления липидов
1. Инициация: образование свободного радикала (L•)
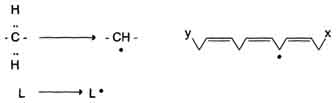
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
L • + О2 → LOO •
LOO• + 1LH → LOOН + 1L•
Развитие цепи происходит при присоединении О2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Обрыв цепи - взаимодействие радикалов между собой:
LOO• + L• → LOOH + LH
L• + vitE → LH + vitE•
vitE• + L• → LH + vit Еокисл.
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
4) Разрушение структуры окисленных липидов
Конечными продуктами перекисного окисления ненасыщенных жирных кислот являются гидроперекиси жирных кислот, которые подвергаются дальнейшей деструкции с образованием различных спиртов, кетонов, альдегидов и диальдегидов, эпоксидов и др. соединений. Наибольший интерес представляет малоновый диальдегид.
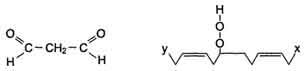
Малоновый диальдегид способен образовывать ковалентные связи с со свободными аминогруппами различных молекулярных соединений по типу шиффовых оснований с образованием стабильных продуктов. Кроме этого, до настоящего времени используется цветная реакция малонового диальдегида с тиобарбитуровой кислотой для оценки интенсивности перекисных процессов в биологических системах
Повреждение клеток в результате перекисного окисления липидов
Активные формы кислорода повреждают структуру нуклеопротеидов, белков, фосфолипидов, входящих в различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидрофильных каналов, образованных гидропероксидами жирных кислот, в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и к последующему их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшена), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении. Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты - вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
МЕХАНИЗМ ПОВРЕЖДАЮЩЕГО ДЕЙСТВИЯ ПРОДУКТОВ ПОЛ
В организме свободно радикальному окислению в первую очередь подвергаются полиненасыщенные жирные кислоты, входящие в структуру мембранных фосфолипидов. Поэтому активация ПОЛ, которая может быть вызвана самыми различными факторами,прежде всего вызывает структурно-функциональные изменения в клеточных мембранах.
А. Повышение проницаемости Наиболее характерным и ранним признаком активации ПОЛ является повышение проницаемости мембран. Конкретный механизм увеличения проницаемости биологических мембран различен:
1) изменение заряда на поверхности раздела мембрана- раствор;
2) изменение конформации мембранного липопротеидного комплекса;
3) образование молекул - переносчиков ионов, и, наконец, появление гидрофильных зон всплошном гидрофобном слое мембраны (лизофосфолипидов)
Последняя причина обычно рассматривается в качестве наиболее вероятной. Действительно, жирные кислоты определяют малую проницаемость гидрофобной зоны мембран для полярных соединений. Появление в этой гидрофобной зоне гидрофильных полярных группировок может привести к образованию водных пор, резко нарушить стабильность мембраны вплоть до её полного разрыва.
Повышению проницаемости способствует образование лизофосфатидов вследствие отщепления окисленных радикалов полиеновых жирных кислот от молекул фосфолипидов под действием фосфолипазы А2.
В лаборатории Ю.А. Владимирова было, показано, что соединениями, ответственными за изменение проницаемости бимолекулярной фосфолипидной мембраны являются не гидроперекиси, а продукты их дальнейшего превращения, по-видимому, карбонильной природы. Можно полагать, что эти соединения снижают поверхностный заряд на мембране –за счет шиффовых оснований, образованных малоновым диальдегидом с фосфатидилэтаноамином.
Повышением проницаемости и снятием мембранного электрохимического потенциала ионов водорода объясняется и резкое разобщение окислительного фосфорилирования в митохондриях, которое всегда имеет место при стимуляции ПОЛ в организме.
Б.Образование комплексов. ПОЛ влияет и на белковые молекулы. Наиболее важные изменения в белковых молекулах, вызываемые окисленными липидами, заключается в образовании комплекса белок-окисленный липид , полимеризации белковых молекул и полимеризации фосфолипидов.
Образование белок-липидных комплексов может быть обусловлено возникновением прочной химической связи между свободными аминогруппами аминокислот и альдегидными или карбоксильными группами окисленных липидов, либо за счёт гидрофобных взаимодействий. Наиболее важную роль в образовании комплексов играет малоновый диальдегид (МДА) – О=СН-СН2-НС=О -один из конечных продуктов ПОЛ.
В образовании шиффовых оснований могут принимать участие фосфолипиды, например, ФЭА.
МДА образует шиффовы основания, взаимодействуя с ε-аминогруппами лизина или N-концевыми остатками аминокислот в молекуле белка. Реакцию образования внутримолекулярных и поперечных межмолекулярных сшивок можно представить следующим образом:
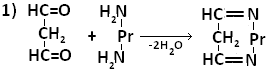
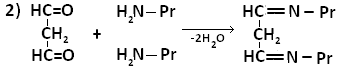
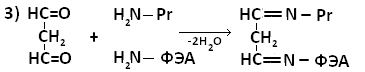
Таким образом МДА может образовывать межлипидные, межбелковые и белок-липидные комплексы. Если такие комплексы образуют функциональные белки (ферменты,рецепторы), активность их резко изменяется. Кроме того, образование комплексов делает клеточные мембраны более ригидными, что резко затрудняет работу ферментов, т.е. активные центры оказываются как бы замурованными, и конформационные изменения, лежащие в основе изменения активности ферментов осуществляются с трудом.
Ригидность мембраны ограничивают и конформационные изменения рецепторных белков, что приводит к нарушению передачи сигналов из окружающей мембрану внешней среды.
Полимерные липид-белковые комплексы могут быть легко обнаружены флуориметрически, так как эти полимеры стабильны. Флуориметрия считается наиболее адекватным методом исследования ПОЛ. Примером подобных стабильных липид-белковых комплексов может служить старческий пигмент липофусцин.
В.Окисление аминокислот и белков, содержащих сульфгидрильные группы.
Полагают, что повреждение сульфгидрильных групп происходит не за счет действия гидроперекисей, а в результате реакций со свободными радикалами:
1) RO2•- HS-Pr → ROOH+.SРr
2) PrS• + .SPr → PrSSPr
3) PrS• + O2 → PrSO2 → PrSO2H → (PrSO2)
В низкомолекулярных соединениях преобладает реакция димеризации (2), в белковых молекулах - реакциях с растворенным кислородом (3).
Ясно, что если окислению подвергаются SН-содержащие молекулы белков-ферментов, активность их резко нарушается, вплоть до полного ингибирования,в ДНК происходит разрыв нитей и т.п.
ПЕРЕКИСНАЯ ГИПОТЕЗА ГИБЕЛИ КЛЕТОК. СИСТЕМЫ АНТИОКСИДАНТНОЙ ЗАЩИТЫ. РОЛЬ ПОЛ В НОРМЕ И ПРИ ПАТОЛОГИИ
Суммируя данные литературы по повреждающемудействию окисленных препаратов ПЖК на субклеточные структур , искусственные мембраны и белковые молекулы, а также об участии процессов ПОЛ в развитии патологических состояний Ю.А. Владимиров и А.И. Арчаков (1972) выдвинули гипотезу перекисной гибели клеток.
Повреждение мембран наиболее вероятная причина необратимых нарушений, приводящих к биологической гибели клеток.
Гипотезу Ю.А. Владимиров и А.И. Арчаков можно проиллюстрировать следующей схемой (Рис.9)
Существует 3 причины, говорящие в пользу правильности такого представления: во первых: в биологических мембранах или в их непосредственном окружении содержатся субстраты перекисного окисления – ненасыщенные жирные кислоты и главный инициатор процесса – негеминовое железо, а также вещества, способныерегенерировать активную двухвалентную форму железа (аскорбиновая кислота, Н-соединения) или, наоборот, катализировать его окисления с превращением и образовании радикалов (например, фосфаты). В нормально функционирующей клетке скорость перекисного окисления ограничено структурным фактором и действием природных антиоксидантов. Нарушение молекулярной организации мембран или разрушение антиоксидантов, равно как и ряд других, не до конца еще изученных факторов, могут приводить к усилению реакций перекисного окисления.
Во-вторых: процесс ПОЛ имеет автокаталитический, самоускоряющийся характер. Причины такого механизма различны в модельных системах и в клетке, в первом случае он обусловлен ценной природой процесса с выраженным разветвлением цепей, во втором к атому добавляется разрушение антиоксидантов и повреждение структуры мембран, вызванное образованием липидных перекисей и в свою очередь ускоряющее их накопление. Так или иначе процесс перекисного окисление липидов, раз начавшись, идет со все возрастающей скоростью и остановить его чрезвычайно трудно.
И, наконец, в третьих, очень существенна высокая токсичность продуктов перекисного окисления. Вызывая полимеризацию белков, разрушение сульфгидрильных групп ферментов и изменение проницаемости липидного бислоя и биологических мембран, эти продукты приводят в первую очередь к нарушению функций и разрушению тех самых структур, в которых идет этот процесс, т.е. мембран клеток.
ПОВРЕЖДАЮЩИЙ
ФАКТОР
система генерирования антиоксидантная
свободных радикалов ==== система
активирование ПОЛ
деструкция деструкция
белков фосфолипидов
нарушение функции
биомембран
повышение нарушение нарушение проницаемости рецепции активностиферментов
Na+ Сa2+ активирование дезинтеграция метаболизма
гидролаз
гибель клетки
Рис.4. Схема гибели клетки вследствие активирования ПОЛ.
АНТИОКСИДАНТНАЯ СИСТЕМА ОРГАНИЗМА
Существование животных организмов и человека в кислородсодержащей воздушной среде, обеспечивающей постоянное генерирование АФК и образование токсических продуктов свободнорадикального окисления, было бы невозможно без системы, нейтрализующей эти процессы. Действительно, в организме действует антиоксидантная система (АОС), сопоставимая по мощности с системой стимулирующей свободнорадикального окисления, так что оба процесса являются уравновешенными. Поэтому в физиологических условиях организм использует систему свободнорадикального окисления для обеспечения процессов жизнедеятельности, не вызывая при этом повреждения биологических структур, так все процессы ПОЛ на каждом этапе находятся под контролем и регулируются соответствующими компонентам АОС.
Выделяют три уровня регуляции интенсивности свободнорадикального окисления. Первая уровень - поддержание в клетках и тканях сравнительного низкого парциального давления кислорода. Сюда в первую очередь относятся дыхательные ферменты, обеспечивающие в организме различные окислительные реакции. Несмотря на широкую изменчивость поглощения организмом кислорода и выделения из него СО2, уровень кислорода и углекислого газа в артериальной крови сохраняется довольно постоянным. Следует отметить, что провоцирующим фактором, стимулирующим свободнорадикальное окисление, может выступать как гипероксия, так и гипоксия, так в условиях гипоксии возрастает содержание восстановленных кофакторов, катализирующих образование АФК (Ю.А.Владимиров, 2000).
Второй уровень защиты – антирадикальный, который обеспечивается веществами различного характера, существующими в организме, нейтрализующими свободные радикалы, переводя их в нерадикальные соединения.
Третий уровень – антиперекисный заключается в уничтожении уже образовавшихся перекисей.
Подобно системе свободнорадикального окисления в АОС действуют как ферментативные, так и неферментативные механизмы. В организме существует целый ряд взаимосвязанных антиоксидантных систем, основная роль которых заключается в поддержании ферментативных и неферментативных реакций свободнорадикального окисления на стационарном регулируемом уровне. На каждом этапе развития ПОЛ существует своя специализированная система, осуществляющая эти антиоксидантные функции. Часть из этих систем строго специфична, например, супероксиддисмутаза, каталаза, другие, такие как глутатионпероксидаза или α-токоферол, обладают большей широтой действия и меньшей субстратной специфичностью. Следует подчеркнуть то обстоятельство, что одна часть тканевых антиоксидантов имеет гидрофильный, другая – гидрофобный характер, что делает возможной одновременную защиту от окисляющих агентов функционально важных молекул как в водной, так и в липидной фазах. Аддитивность взаимодействия ферментативных и неферментативных антиоксидантных систем между собой обеспечивает устойчивость организма к действию экстремальных факторов, стимулирующих развитие свободнорадикальных реакций.
| <== предыдущая страница | | | следующая страница ==> |
| ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ | | | АНТИОКСИДАНТЫ НЕФЕРМЕНТАТИВНОЙ ПРИРОДЫ |
Дата добавления: 2014-10-17; просмотров: 2913; Нарушение авторских прав

Мы поможем в написании ваших работ!