
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
КВАНТОВОХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О КООРДИНАЦИОННЫХ СОЕДИНЕНИЯХ
Координационными или комплексными соединениями называются соединения, содержащие центральный атом или ион и группу молекул или ионов его окружающих и связанных с ним (лигандов). Число лигандов, связанных с центральным атомом, называется координационным числом. Координационное число центрального атома обычно превышает его валентность. Высокая устойчивость многих комплексных соединений указывает, что химическая связь в них не отличается по своей природе от химической связи в обычных ионных или ковалентных соединениях.
В большинстве координационных соединениях центральным является ион
переходного металла Ti3+,Co3+,Fe2+, а лигандами – ионы или полярные молекулы
[FeF6]4- [Fe(CN)6]4-
Электростатические представления легли в основу теории комплексных соединений, так называемой теории кристаллического поля, учитывающей квантовохимические особенности строения оболочки центрального атома.
В свободном атоме или ионе энергии всех d-электронов,принадлежащих к одной и той же электронной оболочке, одинаковы. Лиганды, присоединяемые к положительному иону, являются или отрицательными ионами или полярными молекулами, повернутые к комплексообразователю своим отрицательным концом. Между d-орбиталями и отрицательными лигандами действуют силы отталкивания, увеличивающие энергию d-электронов.В результате этого взаимодействия энергия d-электронов на d-орбиталях,расположенных близко к лигандам возрастает, а энергия электронов на d-орбиталях,удаленных от лигандов, уменьшается, т.е. под действием лигандов происходит расщепление энергетических уровней d-орбиталей и происходит замена d-уровня новым, расщепленным на несколько подуровней.
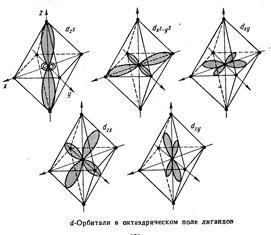
Так, например, первоначально пятикратно вырожденный d-уровень в центральном ионе переходного элемента при образовании октаэдрических комплексов расщепляется на два подуровня с более высоким значением энергии еg и три подуровня с более низким значением энергии t2g
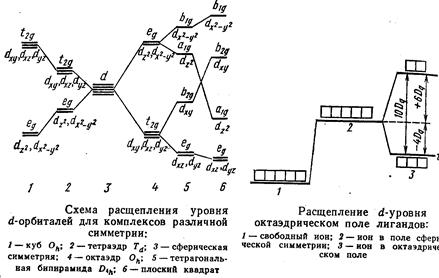
Расщеплением кристаллического поля объясняется, почему ионы большинства комплексных соединений окрашены. Энергия переходов между t2g и eg уровнями невелика и ей отвечают частоты полос поглощения в видимой области спектра.
| <== предыдущая страница | | | следующая страница ==> |
| ТЕОРИЯ ВАЛЕНТНЫХ СВЯЗЕЙ | | | Ориентационное и индукционное взаимодействие |
Дата добавления: 2014-03-11; просмотров: 326; Нарушение авторских прав

Мы поможем в написании ваших работ!