
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция № 17. Обмен белков (продолжение)
1. ИСТОЧНИКИ АМИНОКИСЛОТ В КЛЕТКЕ И ПУТИ ИХ ИСПОЛЬЗОВАНИЯ.
2. МЕТАБОЛИЗМ АМИНОКИСЛОТ.
3. ОБРАЗОВАНИЕ АММИАКА И ПУТИ ЕГО ОБЕЗВРЕЖИВАНИЯ. СИНТЕЗ МОЧЕВИНЫ.
Источниками аминокислот в клетке являются:
1. белки пищи после их гидролиза в органах пищеварения,
2. синтез заменимых аминокислот,
3. распад тканевых белков.
Тканевые белки подвергаются гидролитическому расщеплению при участии тканевых ПРОТЕАЗ - КАТЕПСИНОВ, которые в основном находятся в ЛИЗОСОМАХ, но могут быть и в МИТОХОНДРИЯХ и ЭПС.
Эти ферменты обладают специфичностью действия. Выделяют разные КАТЕПСИНЫ. которые отличаются оптимумом рН и специфичностью действия на ПЕПТИДНЫЕ связи. Распад тканевых белков необходим для обновления белков, а также для устранения дефектных молекул белка.
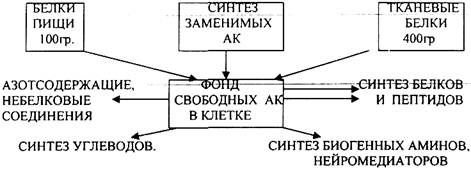
Часть аминокислот в тканях подвергается различным метаболическим превращениям.
1. Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ -реакции между АМИНО- и КЕТОКИСЛОТАМИ, когда они обмениваются своими функциональными группами, при этом аминокислоты являются донорами аминогрупп, а кетокислоты - их акцепторами. Эти реакции катализирует фермент -
51.
АМИНОТРАНСФЕРАЗА. Она локализуется в МИТОХОНДРИЯХ и ЦИТОПЛАЗМЕ. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. В организме человека обнаружено 10 различных АМИНОТРАНСФЕРАЗ. Наибольшее значение имеют AT, донорами аминогрупп которых являются АЛА, АСП, ГЛУ. ГЛУТАМИНОВАЯ кислота является универсальным донором, а альфа -КГК - универсальным акцептором аминогрупп.
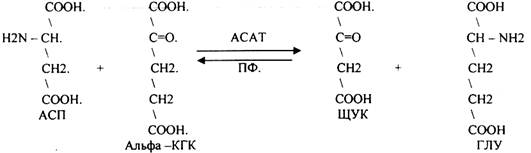
Роль реакций ТРАНСАМИНИРОВАНИЯ:
1. используются для синтеза заменимых аминокислот. При этом происходит перераспределение азота в органах и тканях.
2. Является начальным этапом катаболизма аминокислот
3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа -КЕТОКИСЛОТЫ, которые поступают в ЦТК и включаются в ГЛЮКОНЕОГЕНЕЗ.
4. Протекают в разных тканях, но более всего в печени. Определение активности AT имеет диагностическое значение в клинике. АСАТ наиболее активна в миокарде, следовательно, повышение в сыворотке крови АСАТ можно предположить патологию в сердечной мышце. АЛАТ (АЛАНИНОВАЯ AT) особенно активна в печени, следовательно, повышение её в сыворотке крови свидетельствует о деструктивных изменениях в печени. При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ:
1. АЛА + альфа-КГК ↔ ГЛУ + ПВК
2. ГЛУ + ЩУК ↔АСП + альфа-КГК
2.Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2. При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ). Среди них могут быть соединения, которые выполняют функции:
1. НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИН, ДОФАМИН, ГАМК),
2. Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН),
3. Регуляторы местного действия ( ГИСТАМИН).
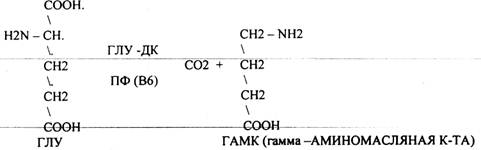
ГАМК является НЕИРОМЕДИАТОРОМ тормозного действия, поэтому препараты на основе ГАМК используются в клинике для лечения некоторых заболеваний ЦНС. Эта реакция используется в педиатрической практике: детям при сильном возбуждении используют раствор витамина В6, который стимулирует процесс образования ГАМК. ДОФАМИН является НЕИРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОР АДРЕНАЛИНА.
52.
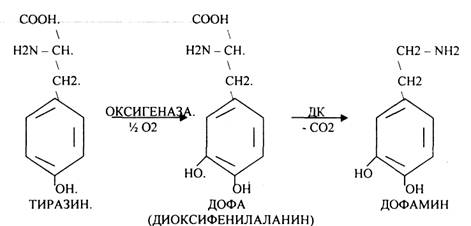
ГИСТАМИН повышает секрецию желудочного сока, поэтому применяется в клинической практике при зондировании. Обладает сосудорасширяющим действием, понижает АД.
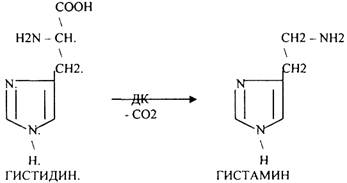
3.Реакции ДЕЗАМИНИРОВАНИЯ - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды ДЕЗАМИНИРОВАНИЯ.
1. Восстановительное
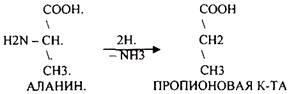
2.ГИДРОЛИТиЧЕСКОЕ:
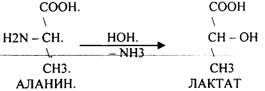
3. Внутримолекулярное:

Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении, т.е. идут в толстой кишке.
4. Окислительное. Протекает в клетке. Непосредственно, ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ. 53.
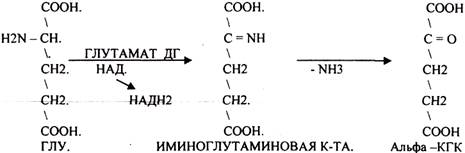
ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ. Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ). Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кровь системы воротной вены, здесь концентрация аммиака больше, чем в общем кровотоке.
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 - 0,7мг/л). Особенно выраженное токсическое действие он оказывает на нервные клетки, поэтому значительное его повышение приводит к серьёзным нарушениям обменных процессов в нервной ткани.
ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА.
1. образование АМИДОВ
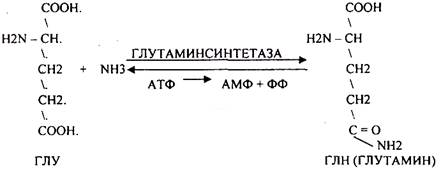
ГЛУТАМИН и АСПАРАГИН - нетоксические вещества. Их называют транспортной формой аммиака в организме. Они не проникают через мембраны и в почках распадаются до аминокислот и аммиака.
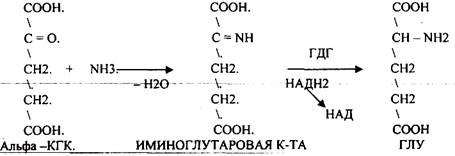
2. Восстановительное АМИНИРОВАНИЕ.
3. Образование солей АММОНИЯ.
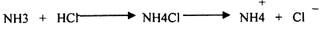
4. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ.
КАРБОМОИЛФОСФАТ

54.
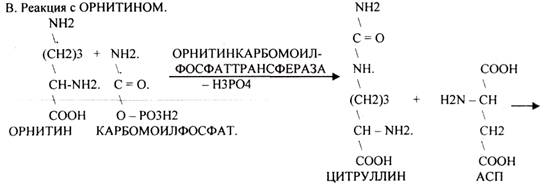
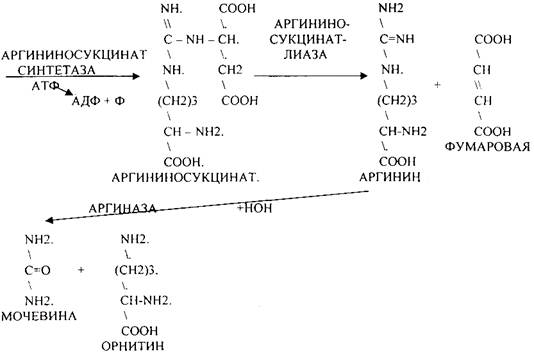
АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе
мочевины содержится два атома азота: один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в
МИТОХОНДРИЯХ, остальные в цитоплазме.
В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино-
образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из
организма, как конечный продукт азотистого обмена.
| <== предыдущая страница | | | следующая страница ==> |
| Лекция № 16. Обмен белков | | | Лекция № 18. Распад НУКЛЕОПРОТЕИНОВ. Нарушение обмена белков |
Дата добавления: 2014-04-15; просмотров: 562; Нарушение авторских прав

Мы поможем в написании ваших работ!