
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция № 4 Комплексоно-метрическое титрование
- метод титриметрического анализа, основанный на реакциях образования комплексных соединений между определяемым компонентом анализируемого раствора и титрантом.
Реакции, используемые в этом методе, должны удовлетворять тем же требованиям, которые предъявляются к реакциям в титриметрическом анализе. Это значит, что реакции должны протекать быстро, строго стехиометрично, иметь характеристики, необходимые для обнаружения точки эквивалентности при помощи различных способов, должны протекать практически до конца, т.е. не меньше, чем на 99,99 %.
Характеристика комплексных соединений
Теория комплексных соединений Альфреда Вернера (1866-1919 гг.), согласно которой комплексные соединения – это вещества (молекулы,ионы), которые состоят из М – комплексообразователя (центральный ион, атом) и связанного с ним донорно-акцепторной или ковалентной связями лигандов L.
K3[Fe(CN)6] – гексоцианоферрат III калия
К+-внешняя координационная сфера
Fe3+ - центральный ион-комплексообразователь
[Fe(CN)6]3- - внутренняя координационная сфера (ион комплексообразователь + лиганд)
СN- - лиганд (характеризуется дентантностью (от лат. dentatus-зубчатый) – способность лигандов занимать определенное число мест около комплексообразователя: моно- ионы или молекулы, имеющие 1 непод.электр.пару (NH3, H2O, CN-, HO-, F-, Cl-, J- и др.) Лиганды, занимающие 2 координационных места, - би – или двудентантные (C2O42-, C2O32-, H2N-CH2-CH2-NH2 и др.). Дентантность определяется числом связей, которые лиганд способен образовывать с центральным атомом. Полидентантные лиганды с ионами металлов образуют комплексные соединения циклического строения, называемые хелатами (от англ. Chelate - клешня)- этилендиаминтетрауксусная кислота.
Важной характеристикой комплексных соединений является – координационное число N – число лигандов, связанное с комплексообразователем во внутренней координационной сфере (наиболее часто N=6,4 реже 2).
Равновесие в растворах комплексных соединений
Образование комплексных соединений происходит ступенчато. Каждая ступень характеризуется константой равновесия, которая называется константой устойчивости:
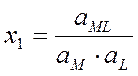 | 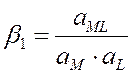 |

 М + L « ML
М + L « ML
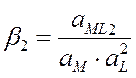
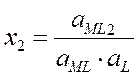 ML + L « ML2
ML + L « ML2
- - - - - - - - -
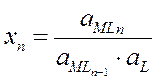 | 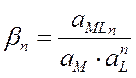 | ||
MLn-1 + L « MLn
x1, x2, xn – ступенчатые константы устойчивости (в справочнике Лурье)
b1, b2, bn – общие константы устойчивости (b1 = x1, b2= x1×x2, bn= x1×x2×xn), величина обратная b обозн. Кн= 1/b – конст. нейстойкости.
Влияние температуры на равновесия в растворах комплексных соединений.
Зависимость константы устойчивости от температуры имеет вид:
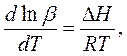 |
Где DН – тепловой эффект реакции, кДж/моль,
R- универсальная газовая постоянная, равная 8,31 Дж/моль×К,
Т – абсолютная температура, К.
При протекании экзотермических реакций (DН>0) константы устойчивости с ростом температуры уменьшаются, а при протекании эндотермических – увеличиваются. Температурная зависимость констант устойчивости многих координационных соединений имеет вид вогнутой параболы, т.е. с ростом температуры устойчивость проходит через минимум.
Рабочие растворы
Комплексоны –органические производные аминополикарбоновых кислот
Наиболее часто используют три
Комплексон I– это трехосновная нитрилотриуксусная кислота (НТА): H3Y
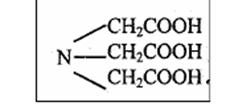
Комплексон II –этилендиаминтетрауксусная кислота (ЭДТА): H4Y
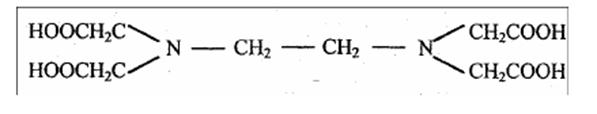
Этот реагент образует шестидентантный лиганд, поскольку он может координироваться с ионом металла двумя атомами азота и четырьмя атомами кислорода карбоксильных групп. Комплексон II – это четырехосновная кислота и обозначается обычно H4Y , где Y4- – этилендиаминтетраацетат-ион.
Белое кристаллическое вещество, малорастворимое в воде (при 200 С – 28,3 мг в 100 мл воды) и мин. при рН=1,6-1,8. В водных растворах в зависимости от рН могут существовать 5 форм ЭДТА м.д которыми устанавливается равновесие:
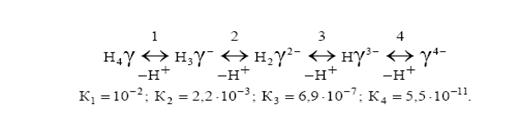
Константы устойчивости комплексов ионов с ЭДТА приводятся в справочнике Лурье и чем выше устойчивость образовавшегося комплекса, тем ниже значение рН комплексонометрического титрования.
На практике применяют двунатриевую соль этилендиаминтетрауксуснoй кислоты, комплексон III,или трилон Б: Na2H2Y×2H2O (дигидрат)
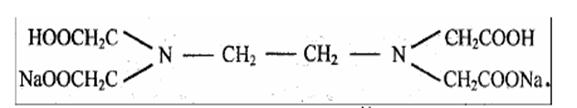
Рабочий раствор комплексона III готовят по точной навеске. Эта соль легко получается в чистом виде, хорошо растворяется в воде, ее растворы устойчивы при хранении.
| <== предыдущая страница | | | следующая страница ==> |
| Кислотно-основные индикаторы | | | Строение внутрикомплексных солей |
Дата добавления: 2014-04-30; просмотров: 705; Нарушение авторских прав

Мы поможем в написании ваших работ!