
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Риторика. Аргументирующая речь
| Название | Степень окисления | Оксиды | Гидроксиды | Соли | |||
| Формула | Характер | Формула | Название | Формула иона | Название | ||
| Cr | +2 | CrO | основный | Cr(OH)2 | Гидроксид хрома (II) | Сr2+ | Соли хрома (II) |
| +3 | 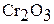
| амфотерный | 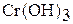
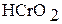
| Гидроксид хрома (III) Хромистая кислота | 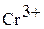
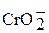
| Соли хрома (III) Хромиты | |
| +6 | 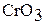
| кислотный | 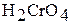
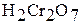
| Хромовая кислота Дихромовая кислота | 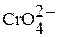
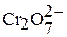
| Хроматы Дихроматы | |
| Mo | +6 | 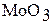
| кислотный | 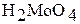
| Молибденовая кислота | 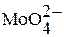
| Молибдаты |
| W | +6 | 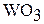
| кислотный | 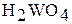
| Вольфрамовая кислота | 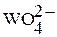
| Вольфраматы |
При растворении хрома в соляной кислоте образуется раствор голубого цвета, содержащий хлорид хрома (II) 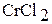 . Если к этому раствору добавить раствор щелочи, то выпадает желтый осадок гидроксида хрома (II) Cr(OH)2.
. Если к этому раствору добавить раствор щелочи, то выпадает желтый осадок гидроксида хрома (II) Cr(OH)2.
Бинарные соединения хрома (II), а также Cr(OH)2 проявляют восстановительные свойства. Оксид хрома (II) получить трудно. Гидроксид Cr(OH)2 (желтый) взаимодействуй только с кислотами:
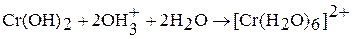 ,
,
образующиеся при этом аквакомплексы имеют синий цвет, такую же окраску имеют кристаллогидраты, например, 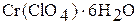 .
.
Являясь сильными окислителями, соли хрома (II) в растворах легко окисляются кислородом воздуха:
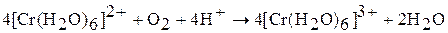
а при отсутствии окислителя даже восстанавливают воду:
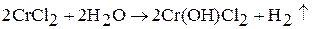
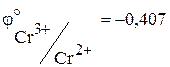 В.
В.
Оксид хрома (III) 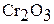 получают при прокаливании
получают при прокаливании 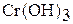 ,
, 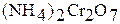 ,
, 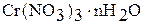 . Например:
. Например:
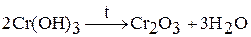
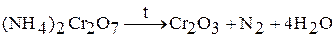
Оксид хрома (III) 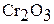 – темно-зеленый порошок, а в кристаллическом состоянии – черный с металлически блеском.
– темно-зеленый порошок, а в кристаллическом состоянии – черный с металлически блеском.
Оксид хрома (III) тугоплавок ( 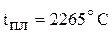 ), химически инертен; в воде, кислотах, щелочах не растворяется. Его амфотерные свойства проявляются при сплавлении с соответствующими соединениями. При сплавлении
), химически инертен; в воде, кислотах, щелочах не растворяется. Его амфотерные свойства проявляются при сплавлении с соответствующими соединениями. При сплавлении 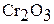 с щелочами и соответствующими основными оксидами образуются хромиты. Например:
с щелочами и соответствующими основными оксидами образуются хромиты. Например:
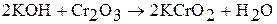
При сплавлении с силикатами оксид хрома (III) окрашивает их в зеленый цвет, поэтому применяется для окраски стекла и фарфора.
Гидроксид хрома (III) образуется при взаимодействии солей хрома (Ш) раствором щелочи:
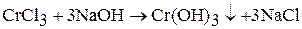
Гидроксид хрома (III) амфотерен. Взаимодействует с растворами щелочей:
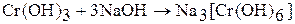
Гидроксид хрома (III) имеет переменный состав 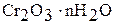 . Это многоядерный слоистый полимер, и котором роль лигандов играют группы ОН- и Н2О, а роль мостиков – ОН-группы. Свежеприготовленный гидроксид хрома (III) – аморфный осадок. Хорошо растворяется в растворах кислот и щелочей:
. Это многоядерный слоистый полимер, и котором роль лигандов играют группы ОН- и Н2О, а роль мостиков – ОН-группы. Свежеприготовленный гидроксид хрома (III) – аморфный осадок. Хорошо растворяется в растворах кислот и щелочей:
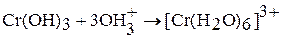 (сине-фиолетовый раствор)
(сине-фиолетовый раствор)
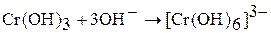 (изумрудно-зеленый раствор)
(изумрудно-зеленый раствор)








 Получение гидроксида хрома (III) и его переход в катионные
Получение гидроксида хрома (III) и его переход в катионные 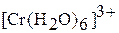 и анионные
и анионные 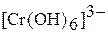 комплексы можно выразить суммарным уравнением:
комплексы можно выразить суммарным уравнением:
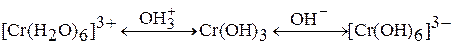
Соединения хрома (III) проявляют восстановительные свойства:
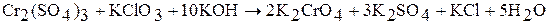
Аквакомплекс 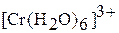 входит в состав ряда кристаллогидратов, например, в хромокалиевые квасцы
входит в состав ряда кристаллогидратов, например, в хромокалиевые квасцы 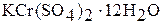 .
.
Оксиды хрома (VI), молибдена (VI), вольфрама (VI) – кристаллические вещества. 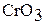 – темно-красный),
– темно-красный), 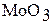 – белый,
– белый, 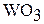 – желтый.
– желтый.
При нагревании 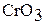 легко разлагается, выделяя кислород, а
легко разлагается, выделяя кислород, а 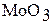 и
и 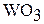 в газовую фазу переходят без разложения.
в газовую фазу переходят без разложения.
Оксид хрома (VI) – окислитель; со многими окисляющимися веществами он реагирует со взрывом. Ядовит.
Оксид хрома (VI) в отличие от 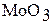 и
и 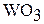 легко растворяется в воде, образуя хромовую кислоту, то есть является кислотным оксидом:
легко растворяется в воде, образуя хромовую кислоту, то есть является кислотным оксидом:
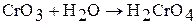
Кислотный характер оксидов молибдена (VI) и вольфрама (VI) проявляется при растворении в щелочах:

Тетраоксохромат (VI) водорода 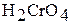 в свободном состоянии не выделен. В водном растворе – это сильная кислота; она называется хромовой.
в свободном состоянии не выделен. В водном растворе – это сильная кислота; она называется хромовой.
Растворимы в воде оксохроматы (VI), оксомолибдаты (VI) и оксовольфраматы (VI) s-элементов I группы, а также магния и кальция. Ионы 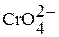 имеют желтую окраску, ионы
имеют желтую окраску, ионы 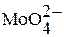 и
и 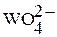 – бесцветны.
– бесцветны.
Для Мо (VI) и W (VI) известны многочисленные производные полимерных оксоанионов весьма сложного состава и строения. Способность к полимеризации иона 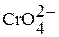 выражена менее отчетливо, тем не менее известны, например,
выражена менее отчетливо, тем не менее известны, например,  – дихромат,
– дихромат, 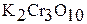 – трихромат,
– трихромат, 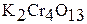 – тетрахромат.
– тетрахромат.
Полихроматы образуются при действии кислот на хроматы. Так, если на концентрированный раствор хромата калия подействовать кислотой, то его окраска сначала станет красно-оранжевой, потом станет более темной за счет образования дихроматов, затем трихроматов и т.д.:
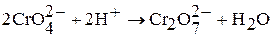
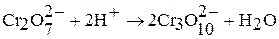
В результате подкисления раствора дихромата калия концентрированной серной кислотой при охлаждении выделяются темно-красные кристаллы оксида хрома (VI):
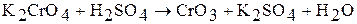
Если же действовать на растворы полихроматов щелочью, процесс идет в обратном направлении и, в конечном счете, получается снова хромат. Взаимные переходы хромата и дихромата можно выразить уравнением обратимой реакции:
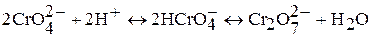
Соединения хрома (VI) – сильные окислители, они переходят в окислительно-восстановительных процессах в производные хрома (III). В нейтральной среде образуется гидроксид хрома (III):
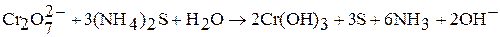
в кислой среде – производные катионного комплекса 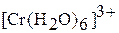 :
:
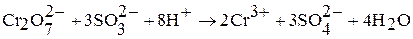
в щелочной среде – производные анионного комплекса 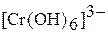 :
:
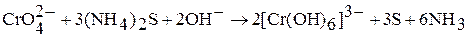
Наибольшая окислительная активность оксохроматов (VI) наблюдается в кислой среде:

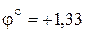 В.
В.








 Окислительная способность соединений хрома (VI) используется в химическом анализе и органическом синтезе.
Окислительная способность соединений хрома (VI) используется в химическом анализе и органическом синтезе.
Окислительные свойства производных Мо (VI) и W (VI) проявляются лишь при взаимодействии с наиболее сильными восстановителями, например с водородом, в момент его выделения.
Из производных хрома и его аналогов применяются главным образом соединения самого хрома. Так, оксид хрома (III) 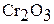 используется для приготовления красок в качестве катализатора,
используется для приготовления красок в качестве катализатора, 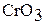 – для электролитического получения хрома и хромированных изделий.
– для электролитического получения хрома и хромированных изделий.
Биологическая роль хрома, молибдена, вольфрама
Хром, молибден, вольфрам – микроэлементы живых организмов. Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6 г хрома (0,1%).
Металлический хром нетоксичен, в соединениях хром (III) и хром (VI) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам. 0,25 – 0,3 г дихромата калия вызывают летальный исход. Соединения хрома (VI) применяются как фунгициды. Соединения хрома (III) благоприятно влияют на рост растений.
Молибден относится к металлам жизни и является одним из важнейших биоэлементов.
В биохимических процессах молибден участвует в степенях окисления V и VI. В этом состоянии он создает устойчивые оксоформы.
Молибден образует устойчивые оксокомплексы: 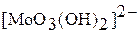 , поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп. В крови преобладает Мо (VI); если лигандом будет кислород, образуются устойчивые изополимолибдат-ионы:
, поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп. В крови преобладает Мо (VI); если лигандом будет кислород, образуются устойчивые изополимолибдат-ионы: 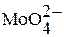 ,
, 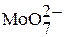 ,
,  ,
, 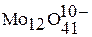 .
.
Избыточное содержание молибдена в пище нарушает метаболизм Са2+ и РО43–, вызывая снижение прочности костей.
Молибден является важнейших микроэлементом растений. По сравнению с другими промышленно важными металлами молибден малотоксичен. Потребление молибдена с продуктами питания составляет 0,1 – 0,3 мг/сут, но необходимое дневное поступление не установлено.
Роль этого микроэлемента в организме человека изучена недостаточно. Анионная форма вольфрама легко адсорбируется в желудочно-кишечном тракте. Металлический вольфрам и его катионные формы не адсорбируются в организме человека.
Риторика. Аргументирующая речь
Используется в ситуациях спора или разногласий, как доказательство чего-то, в агитации, пропаганде, взаимоотношения (отказ, согласие и т.п.), в научной сфере.
Аргументация или ее элементы используются во всех ситуациях и сферах.
При аргументирующей речи предполагается, что у партнеров разные точки зрения на обсуждаемый вопрос. Степень активности в восприятии аргументирующей речи кардинально другая.
Цель: Убедить и доказать
Доказать – достигается за счет логики (объективно)
Убедить – логика+эмоции
Когда говорим об убеждении и аргументации существует два подхода:
1. Логический
2. Риторический
При убеждении может быть не логика, а ее подобие!
Убеждение достигается за счет того, что мы создаем логику или ее подобие.
Убеждение возникает за счет структуры аргументирующей речи, не в меньшей степени, чем за счет аргументов и фактов.
Импульсом к созданию аргументирующей речи является дискуссионный вопрос. Правильный дискуссионный вопрос формулируется таким образом, чтобы на него было дано два прямо противоположных ответа, поэтому используются такие синтаксические структуры как «ли» (важно ли? Правильно ли?), когда ставится двоеточие и антонимы («Смертная казнь: за или против?» «Эвтаназия: добро или зло?»). На основании ответов на дискуссионный вопрос, формулируется тезис и антитезис. (Я ЗА смертную казнь/ я ПРОТИВ смертной казни). Тезис и антитезис прямо противоположны друг другу.
Тезис – суждение, требующее доказательство.
Требования к тезису:
1. Должен быть спорным
2. Должен быть кратким и не противоречивым
3. Тезис должен быть одним и тем же на протяжении всего доказательства
4. Должен быть истинным (желательно)
Примеры:
Темы:
· Люди учатся всю жизнь (не тезис, не спорный)
· Человек должен быть образованным или порядочным? (не тезис, нет противоречивости)
· Класс должен быть большим или маленьким? (большой класс с точки зрения помещения, маленький класс с точки зрения количества человек => противопоставляются несопоставимые вещи, не тезис)
· Земля круглая (не тезис, не точно, Земля шарообразная)
Аргументирующая речь должна быть максимально точной по терминам (понятиям).
Структура аргументирующей речи:
1. Тезис
2. Обоснование тезиса
3. Аргумент №1
4. Пример №1, 2, 3
5. Аргумент №2
6. Пример № 1, 2, 3
7. Вывод
Тезис – это мое утверждение, моя позиция, а у моего оппонента антитезис (его тезис).
Пример: Можно ли воспитать патриотизм? (тезис)
Обоснование1: что такое патриотизм? Любовь к родине, а любовь воспитать нельзя => патриотизм воспитать нельзя.
Обоснование2: что такое патриотизм? Отношение, а отношение воспитать можно =>патриотизм воспитать можно.
Что такое воспитание? Процесс прививания системы ценностей
Аргумент – суждение, его функция – подтверждение справедливости тезиса.
Примеры – конкретный факт (случай), который иллюстрирует (конкретизирует) аргумент.
Вывод = тезису, «что и требовалось доказать».
1. ВЫВОД ДОЛЖЕН БЫТЬ!!!
2.  Ни одним словом вывод не должен отличаться от тезиса! (абсолютно дословное повторение тезиса)
Ни одним словом вывод не должен отличаться от тезиса! (абсолютно дословное повторение тезиса)
3. Ура
4. Добро
5.  Миша
Миша
6. Вероника
7. Ноги
8. !!!
9. Никуленька
Ни тезис, ни аргумент не должны носить печать субъективности! (не должны быть чьим-то мнением)
Аргументативный текст отличается многоуровневостью, многослойностью.
Поэтому главным, с точки зрения убеждения, является не компонент структуры, а демонстрация(-максимально открытое обнажение, прописывание, высказывание, логических связей между всеми компонентами аргументативного текста).
Элементами демонстрации являются:
· Обоснование
· Усиление тезиса в выводе (таким образом вы сами убедились… и т.п.)
· Промежуточные связывающие конструкции (еще одним доказательством является… В-первую очередь пример доказывает… и т.п.)
Основа демонстрации – причинно-следственные отношения. (так как, потому что)
Тезис и вывод – это следствия, а доказываем через причины (аргументы).
Каждый компонент аргументирующей речи требует внимания, относительно того, чтобы не выпадать за границы тезиса. Мы должны понимать, что основная сила убеждения в связках.
Виды аргументов:
·  Собственно аргументы (подтверждают тезис)
Собственно аргументы (подтверждают тезис)
· Контраргументы (опровергают тезис)
·  Сильные (те, против которого сложно подобрать контраргумент/ те что максимально учитывают ценности адресата)
Сильные (те, против которого сложно подобрать контраргумент/ те что максимально учитывают ценности адресата)
· Слабые
·  Риторические (иррациональные/психологические/эмоциональные):
Риторические (иррациональные/психологические/эмоциональные):
1. К аудитории
2. К человеку
· Логические:
1. Факты, события, явления из жизни, истории, литературы
2. Заведомо истинные суждения (аксиомы: законы природы, народные приметы, пословицы и поговорки)
3. Ссылка на авторитеты
Д/з.
· Тема: Всем ли нужно изучать риторику? (на отдельном листочке, только в письменном виде, трех аргументов будет достаточно) Учебник, глава 8, § аргументирующая речь.
· Сами формулируем тезис (любой). Выступление с аргументирующей речью.
| <== предыдущая страница | | | следующая страница ==> |
| Кислородные соединения элементов VI группы побочной подгруппы | | | Психология профессионального образования (ППО) |
Дата добавления: 2014-05-28; просмотров: 1571; Нарушение авторских прав

Мы поможем в написании ваших работ!