
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кислородные соединения элементов VI группы побочной подгруппы
| Название | Степень окисления | Оксиды | Гидроксиды | Соли | |||
| Формула | Характер | Формула | Название | Формула иона | Название | ||
| Cr | +2 | CrO | основный | Cr(OH)2 | Гидроксид хрома (II) | Сr2+ | Соли хрома (II) |
| +3 | 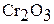
| амфотерный | 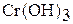
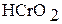
| Гидроксид хрома (III) Хромистая кислота | 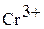
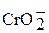
| Соли хрома (III) Хромиты | |
| +6 | 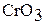
| кислотный | 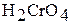
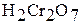
| Хромовая кислота Дихромовая кислота | 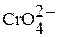
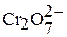
| Хроматы Дихроматы | |
| Mo | +6 | 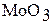
| кислотный | 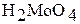
| Молибденовая кислота | 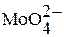
| Молибдаты |
| W | +6 | 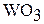
| кислотный | 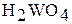
| Вольфрамовая кислота | 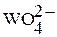
| Вольфраматы |
При растворении хрома в соляной кислоте образуется раствор голубого цвета, содержащий хлорид хрома (II) 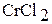 . Если к этому раствору добавить раствор щелочи, то выпадает желтый осадок гидроксида хрома (II) Cr(OH)2.
. Если к этому раствору добавить раствор щелочи, то выпадает желтый осадок гидроксида хрома (II) Cr(OH)2.
Бинарные соединения хрома (II), а также Cr(OH)2 проявляют восстановительные свойства. Оксид хрома (II) получить трудно. Гидроксид Cr(OH)2 (желтый) взаимодействуй только с кислотами:
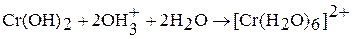 ,
,
образующиеся при этом аквакомплексы имеют синий цвет, такую же окраску имеют кристаллогидраты, например, 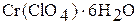 .
.
Являясь сильными окислителями, соли хрома (II) в растворах легко окисляются кислородом воздуха:
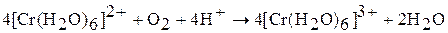
а при отсутствии окислителя даже восстанавливают воду:
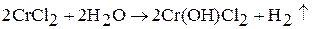
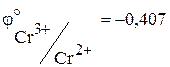 В.
В.
Оксид хрома (III) 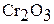 получают при прокаливании
получают при прокаливании 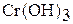 ,
, 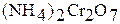 ,
, 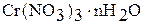 . Например:
. Например:
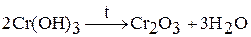
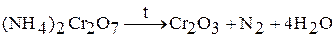
Оксид хрома (III) 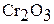 – темно-зеленый порошок, а в кристаллическом состоянии – черный с металлически блеском.
– темно-зеленый порошок, а в кристаллическом состоянии – черный с металлически блеском.
Оксид хрома (III) тугоплавок ( 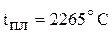 ), химически инертен; в воде, кислотах, щелочах не растворяется. Его амфотерные свойства проявляются при сплавлении с соответствующими соединениями. При сплавлении
), химически инертен; в воде, кислотах, щелочах не растворяется. Его амфотерные свойства проявляются при сплавлении с соответствующими соединениями. При сплавлении 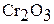 с щелочами и соответствующими основными оксидами образуются хромиты. Например:
с щелочами и соответствующими основными оксидами образуются хромиты. Например:
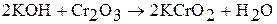
При сплавлении с силикатами оксид хрома (III) окрашивает их в зеленый цвет, поэтому применяется для окраски стекла и фарфора.
Гидроксид хрома (III) образуется при взаимодействии солей хрома (Ш) раствором щелочи:
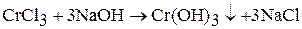
Гидроксид хрома (III) амфотерен. Взаимодействует с растворами щелочей:
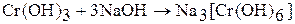
Гидроксид хрома (III) имеет переменный состав 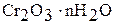 . Это многоядерный слоистый полимер, и котором роль лигандов играют группы ОН- и Н2О, а роль мостиков – ОН-группы. Свежеприготовленный гидроксид хрома (III) – аморфный осадок. Хорошо растворяется в растворах кислот и щелочей:
. Это многоядерный слоистый полимер, и котором роль лигандов играют группы ОН- и Н2О, а роль мостиков – ОН-группы. Свежеприготовленный гидроксид хрома (III) – аморфный осадок. Хорошо растворяется в растворах кислот и щелочей:
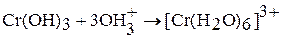 (сине-фиолетовый раствор)
(сине-фиолетовый раствор)
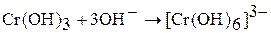 (изумрудно-зеленый раствор)
(изумрудно-зеленый раствор)








 Получение гидроксида хрома (III) и его переход в катионные
Получение гидроксида хрома (III) и его переход в катионные 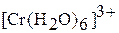 и анионные
и анионные 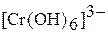 комплексы можно выразить суммарным уравнением:
комплексы можно выразить суммарным уравнением:
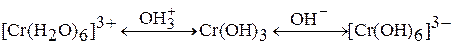
Соединения хрома (III) проявляют восстановительные свойства:
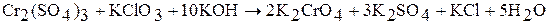
Аквакомплекс 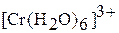 входит в состав ряда кристаллогидратов, например, в хромокалиевые квасцы
входит в состав ряда кристаллогидратов, например, в хромокалиевые квасцы 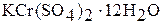 .
.
Оксиды хрома (VI), молибдена (VI), вольфрама (VI) – кристаллические вещества. 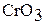 – темно-красный),
– темно-красный), 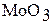 – белый,
– белый, 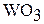 – желтый.
– желтый.
При нагревании 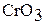 легко разлагается, выделяя кислород, а
легко разлагается, выделяя кислород, а 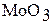 и
и 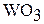 в газовую фазу переходят без разложения.
в газовую фазу переходят без разложения.
Оксид хрома (VI) – окислитель; со многими окисляющимися веществами он реагирует со взрывом. Ядовит.
Оксид хрома (VI) в отличие от 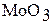 и
и 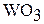 легко растворяется в воде, образуя хромовую кислоту, то есть является кислотным оксидом:
легко растворяется в воде, образуя хромовую кислоту, то есть является кислотным оксидом:
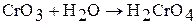
Кислотный характер оксидов молибдена (VI) и вольфрама (VI) проявляется при растворении в щелочах:

Тетраоксохромат (VI) водорода 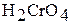 в свободном состоянии не выделен. В водном растворе – это сильная кислота; она называется хромовой.
в свободном состоянии не выделен. В водном растворе – это сильная кислота; она называется хромовой.
Растворимы в воде оксохроматы (VI), оксомолибдаты (VI) и оксовольфраматы (VI) s-элементов I группы, а также магния и кальция. Ионы 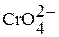 имеют желтую окраску, ионы
имеют желтую окраску, ионы 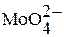 и
и 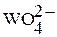 – бесцветны.
– бесцветны.
Для Мо (VI) и W (VI) известны многочисленные производные полимерных оксоанионов весьма сложного состава и строения. Способность к полимеризации иона 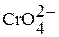 выражена менее отчетливо, тем не менее известны, например,
выражена менее отчетливо, тем не менее известны, например,  – дихромат,
– дихромат, 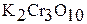 – трихромат,
– трихромат, 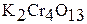 – тетрахромат.
– тетрахромат.
Полихроматы образуются при действии кислот на хроматы. Так, если на концентрированный раствор хромата калия подействовать кислотой, то его окраска сначала станет красно-оранжевой, потом станет более темной за счет образования дихроматов, затем трихроматов и т.д.:
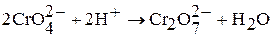
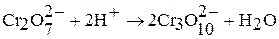
В результате подкисления раствора дихромата калия концентрированной серной кислотой при охлаждении выделяются темно-красные кристаллы оксида хрома (VI):
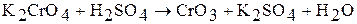
Если же действовать на растворы полихроматов щелочью, процесс идет в обратном направлении и, в конечном счете, получается снова хромат. Взаимные переходы хромата и дихромата можно выразить уравнением обратимой реакции:
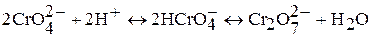
Соединения хрома (VI) – сильные окислители, они переходят в окислительно-восстановительных процессах в производные хрома (III). В нейтральной среде образуется гидроксид хрома (III):
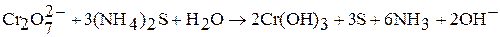
в кислой среде – производные катионного комплекса 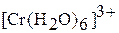 :
:
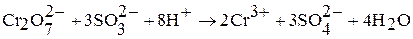
в щелочной среде – производные анионного комплекса 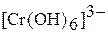 :
:
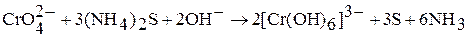
Наибольшая окислительная активность оксохроматов (VI) наблюдается в кислой среде:

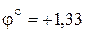 В.
В.








 Окислительная способность соединений хрома (VI) используется в химическом анализе и органическом синтезе.
Окислительная способность соединений хрома (VI) используется в химическом анализе и органическом синтезе.
Окислительные свойства производных Мо (VI) и W (VI) проявляются лишь при взаимодействии с наиболее сильными восстановителями, например с водородом, в момент его выделения.
Из производных хрома и его аналогов применяются главным образом соединения самого хрома. Так, оксид хрома (III) 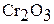 используется для приготовления красок в качестве катализатора,
используется для приготовления красок в качестве катализатора, 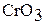 – для электролитического получения хрома и хромированных изделий.
– для электролитического получения хрома и хромированных изделий.
Биологическая роль хрома, молибдена, вольфрама
Хром, молибден, вольфрам – микроэлементы живых организмов. Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6 г хрома (0,1%).
Металлический хром нетоксичен, в соединениях хром (III) и хром (VI) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам. 0,25 – 0,3 г дихромата калия вызывают летальный исход. Соединения хрома (VI) применяются как фунгициды. Соединения хрома (III) благоприятно влияют на рост растений.
Молибден относится к металлам жизни и является одним из важнейших биоэлементов.
В биохимических процессах молибден участвует в степенях окисления V и VI. В этом состоянии он создает устойчивые оксоформы.
Молибден образует устойчивые оксокомплексы: 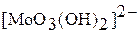 , поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп. В крови преобладает Мо (VI); если лигандом будет кислород, образуются устойчивые изополимолибдат-ионы:
, поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп. В крови преобладает Мо (VI); если лигандом будет кислород, образуются устойчивые изополимолибдат-ионы: 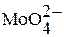 ,
, 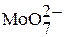 ,
,  ,
, 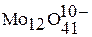 .
.
Избыточное содержание молибдена в пище нарушает метаболизм Са2+ и РО43–, вызывая снижение прочности костей.
Молибден является важнейших микроэлементом растений. По сравнению с другими промышленно важными металлами молибден малотоксичен. Потребление молибдена с продуктами питания составляет 0,1 – 0,3 мг/сут, но необходимое дневное поступление не установлено.
Роль этого микроэлемента в организме человека изучена недостаточно. Анионная форма вольфрама легко адсорбируется в желудочно-кишечном тракте. Металлический вольфрам и его катионные формы не адсорбируются в организме человека.
| <== предыдущая страница | | | следующая страница ==> |
| Свойства элементов VI группы побочной подгруппы | | | Риторика. Аргументирующая речь |
Дата добавления: 2014-05-28; просмотров: 555; Нарушение авторских прав

Мы поможем в написании ваших работ!