
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Ароматические R-группы
|
Читайте также: |
Положительно заряженные R-группы
Отрицательно заряженные R-группы
Полярные, незаряженные R-группы
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ


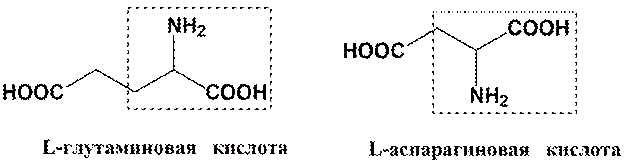

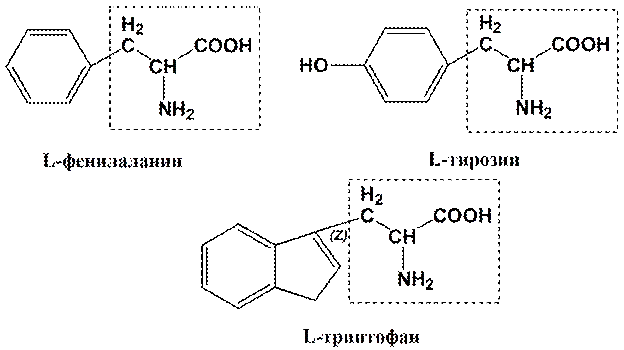
Под первичной структурой белка понимают порядок чередования аминокислотных остатков в полипептидной цепи. Первичная структура белка уникальна и детерминируется генами. К настоящему времени расшифрована первичная структура более тысячи белков из разных организмов, в том числе и человека.
Замена одного лишь аминокислотного остатка в полипептидной цепи может привести к аномальным явлениям. Примером тому служит замена в b-цепи гемоглобина человека остатка глутаминовой кислоты, занимающего шестое положение, на остаток валина. Результатом этого является тяжелое, передающееся по наследству заболевание – серповидноклеточная анемия.
Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества. Содержание азота более или менее постоянно во всех белках (в среднем 16%), поэтому иногда определяют количество белка в биологических объектах по содержанию белкового азота.
Аминокислоты соединяются друг с другом пептидной связью, образуя длинные неразветвленные цепи – полипептиды. Пептидная связь возникает при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы другой с выделением воды. Пептидные связи обладают высокой прочностью, их образуют все аминокислоты. Именно, эти связи образуют первый уровень организации белковой молекулы – первичную структуру белка. Первичная структура –это последовательность аминокислотных остатков в полипептидной цепи белка.

Вторичная структура белкапредставляет собой спиральную структуру, образованную, главным образом, за счет водородных связей. Обычно белковая молекула напоминает растянутую пружину.
Это так называемая α-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами.Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка.
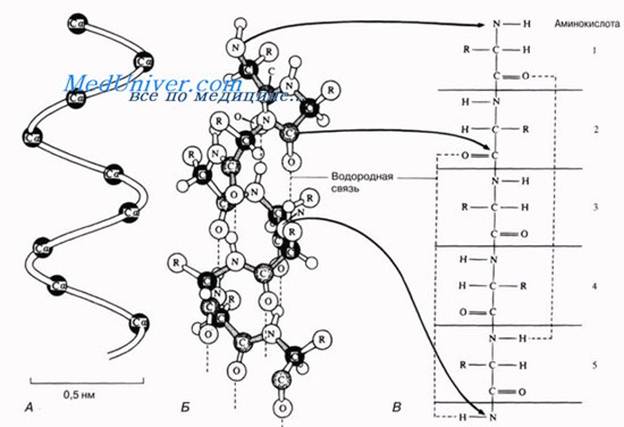
Таким образом, аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Полностью α-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Третичная структура белкапредставляет собой глобулу или клубочек, в которую сворачивается вторичная спираль в некоторых белках. В образовании глобулы участвуют различные межмолекулярные силы, прежде всего дисульфидные мостики. Поскольку дисульфидные связи образуются аминокислотами, которые содержат серу, то глобулярные белкиобычно содержат много серы.
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Поскольку ни первичная структура, ни типы спиралей или сочетания спиральных и линейных участков полипептидной цепи не дают представления об объеме, форме полипептидной цепи, перед исследователем всегда стоит необходимость определения трехмерной или пространственной конфигурации белка. Основную роль в решении этих задач сыграл рентгеноструктурный анализ с высокой разрешающей способностью. Метод успешно решает две главные проблемы химии белков: закономерность последовательностей аминокислотных остатков в полипептиде и закономерность конфигурации молекулы белка.

Доменное строение глобулярных белков (по А.А. Болдыреву).
а -β-субъединица гемоглобина; б -константный домениммуноглобулина; в - флаводоксин; г - лизоцим куриного яйца.
Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы. Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям
Все структурные уровни молекулы белка зависят от первичной структуры. Изменения в доменов, кодируемых разными генами.
Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а нековалентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологическойактивностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает четвертичная структуруа, новое качество, не свойственное мономерному белку.
Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. На рис. представлена структура молекулы гемоглобина, а на рис. 1.24 хорошо видно, чтомолекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет (см. главу 2).
первичной структуре ведут к изменениям на других уровнях организации белка.

Олигомерная молекула гемоглобина (красные диски – группы гема)
Некоторые белки образуют структуру, состоящую из нескольких глобул, называемых тогда субъединицами.Например, молекула гемоглобина состоит из четырех субъединиц, выполняющих единую функцию.
| <== предыдущая страница | | | следующая страница ==> |
| Строение молекулы белка | | | Физико-химические свойства белков |
Дата добавления: 2014-03-11; просмотров: 716; Нарушение авторских прав

Мы поможем в написании ваших работ!