
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Свойства элементов VI группы побочной подгруппы
| Свойство | Сr | Mo | W |
| Заряд ядра | |||
| Металлический радиус, пм | |||
Энергия ионизации
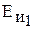 , эВ , эВ
| 6,77 | 7,10 | 7,98 |
| Температура плавления, °С | |||
| Температура кипения, °С | |||
| Плотность, г/см3 | 7,2 | 10,2 | 19,3 |
Стандартный электродный потенциал, 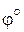 , В , В
| –0,744
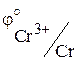
| –0,2
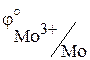
| –0,15
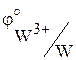
|
| Характерные степени окисления | +2, +3, +6 | +4, +6 | +4, +6 |
Как видно из приведенных в табл. 1 данных, в ряду Cr – Mo – W увеличивается энергия ионизации, в особенности, при переходе от Мо к W. Вольфрам вследствие лантаноидного сжатия имеет металлический радиус, близкий к металлическому радиусу молибдена.
В ряду Сr – Mo – W наблюдается повышение температуры плавления. Это объясняется усилением в металле ковалентной связи, возникающей за счет d-электронов. Вольфрам – самый тугоплавкий из всех металлов. Как и в других подгруппах d-элементов, с ростом атомного номера элемента в ряду Cr – Mo – W химическая активность элементов заметно понижается.
Нахождение в природе
Содержание в земной коре составляет:
| Содержание элементов в земной коре | Сr | Mo | W |
| Массовая доля, % | 8 × 10–3 | 6 × 10–5 | 1 × 10–5 |
Данные элементы встречаются только в виде соединений. Основной минерал хрома – хромит, или хромистый железняк 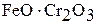 , молибдена – молибденит
, молибдена – молибденит 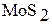 ; вольфрама – шеелит
; вольфрама – шеелит  ;
; 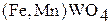 – вольфрамит.
– вольфрамит.
Получение
В промышленности получают как чистый хром, так и его сплав с железом (феррохром). Чистый хром получают восстановлением его оксида алюминием:
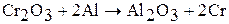
или кремнием (добавление оксида кальция предотвращает образование силицидов).:
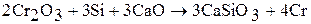
Хром получают восстановлением хромистого железняка алюминием:
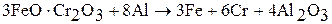
Для производства молибдена молибденовые руды подвергают флотации и перерабатывают пирометаллургическим методом:
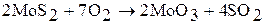
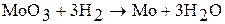
Молибден выделяется в виде порошка. Вольфрам получают восстановлением 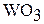 водородом при 850 – 1200 °С и последующим спеканием образовавшегося порошка:
водородом при 850 – 1200 °С и последующим спеканием образовавшегося порошка:
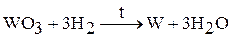
Химические и физические свойства
Хром, молибден, вольфрам – серебристо-белые металлы, очень твердые (царапают стекло) и тугоплавкие. Вольфрам – самый тугоплавкий из металлов.
Рассматриваемые металлы стоят в ряду напряжений перед водородом, однако они мало подвержены коррозии благодаря образованию на их поверхности тонкой оксидной пленки. Хром растворяется в разбавленной соляной и серной кислотах с образованием солей хрома (II):

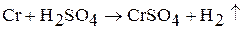
Соединения хрома (II) неустойчивы и легко окисляются до соединений хрома (III).
В отличие от железа, которое пассивируется только концентрированной азотной кислотой, пассивирование хрома вызывается как концентрированной, так и разбавленной азотной кислотой, царской водкой, а также другими сильными окислителями.
Молибден растворяется в азотной кислоте, царской водке и концентрированной серной кислоте:
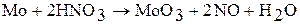
Вольфрам растворяется в царской водке и смеси платковой и азотной кислот:
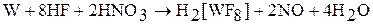
В присутствии окислителей хром, молибден, вольфрам реагируют с расплавами щелочей:
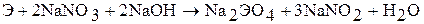
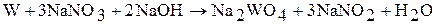
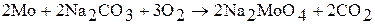
При нагревании хром, молибден, вольфрам начинают окисляться кислородом воздуха (с образованием оксидов), фтором (с образованием фторидов CrF3, MoF6, WF6) хлором (с образование, хлоридов СrС13, МоС16, WC16) и другими простыми веществами (халькогенами, пниктогенами). Например:
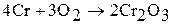
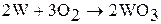
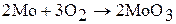
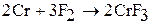
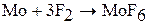
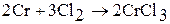
Оксиды молибдена и вольфрама летучи, их пленки не защищают металл от дальнейшего окисления.
Хром, молибден, вольфрам взаимодействуют с углеродом, образуя карбиды – W2C, WC, Мо2С, МоС.
Кислородные соединения хрома, молибдена, вольфрама
Кислородные соединения хрома, молибдена, вольфрама приведены в таблице 2.
Таблица 2
| <== предыдущая страница | | | следующая страница ==> |
| | | Кислородные соединения элементов VI группы побочной подгруппы |
Дата добавления: 2014-05-28; просмотров: 580; Нарушение авторских прав

Мы поможем в написании ваших работ!