
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Металлическая связь
Само название «металлическая связь» указывает, что речь пойдет о внутренней структуре металлов.
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему металлу. Так, по одному электрону содержат 16 элементов, по два – 58, по три – 4 элемента и ни одного — только один Pd. Лишь атомы элементов Ge, Sn и Pb имеют на внешнем уровне по 4 электрона, Sb и Bi – по 5 и Ро – 6. Но эти элементы не являются характерными металлами.
Элементы – металлы образуют простые вещества. В обычных условиях это кристаллические вещества (кроме ртути). Согласно теории «свободных электронов» в узлах решётки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределённый по всему металлу, из нелокализованных валентных электронов. Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества.
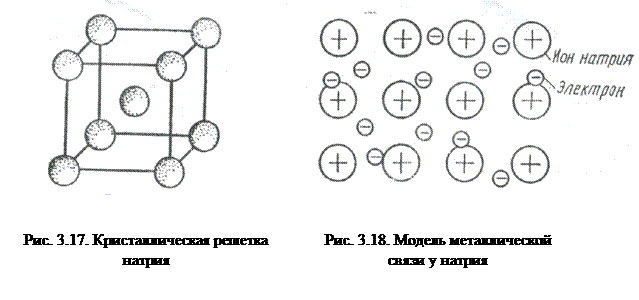 На рис. 3.17 представлена схема кристаллической решетки металла натрия. В ней каждый атом натрия окружен восемью соседними атомами. На примере этого вещества рассмотрим металлическую связь.
На рис. 3.17 представлена схема кристаллической решетки металла натрия. В ней каждый атом натрия окружен восемью соседними атомами. На примере этого вещества рассмотрим металлическую связь.
У атома натрия, как и у всех металлов, имеется избыток валентных орбиталей и недостаток электронов. Так, его валентный электрон (3s1) может занимать одну из 9 свободных орбиталей: 3s (одна), Зр (три) и 3d (пять). При сближении атомов, в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно движутся из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла (рис. 3.18).
Таким образом, металлическая связь – это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобщении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны; в последнем случае возможно взаимное смещение ионов и электронов без нарушения связи. Это говорит о нелокализованности (отсутствии направленности) металлической связи. Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокую электрическую проводимость и теплопроводность, а также ковкость. Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. Именно металлической связью объясняются физические свойства металлов.
Металлическая связь характерна для металлов, находящихся в твердом и жидком состоянии. Это свойство агрегатов атомов, расположенных в непосредственной близости друг к другу. Однако в парообразном состоянии атомы металлов, как и всех веществ, связаны между собой ковалентной связью. Пары´ металлов состоят из отдельных молекул (одноатомных и двухатомных). Прочность связи в кристалле больше, чем в молекуле металла, поэтому процесс образования металлического кристалла протекает с выделением энергии.
| <== предыдущая страница | | | следующая страница ==> |
| Ионная связь | | | Классификация веществ |
Дата добавления: 2014-09-29; просмотров: 320; Нарушение авторских прав

Мы поможем в написании ваших работ!