
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Общие понятия и определения
Реакции, в ходе которых элементы, входящие в состав реагирующих веществ, изменяют степень окисления, называются окислительно – восстановительными (ОВР).
Степень окисления. Для характеристики состояния элементов в соединениях введено понятие степени окисления. Степень окисления (с.о.) – это условный заряд, который приписывается атому в предположении, что все связи в молекуле или ионе предельно поляризованы. Степень окисления элемента в составе молекулы вещества или иона определяется как число электронов, смещенных от атома данного элемента (положительная степень окисления) или к атому данного элемента (отрицательная степень окисления). Для вычисления степени окисления элемента в соединении следует исходить из следующих положений (правил):
1. Степень окисления элементов в простых веществах, в металлах в элементном состоянии, в соединениях с неполярными связями равны нулю.Примерами таких соединений являются N20, Н20, Сl20, I20, Мg0, Fe0 и т.д.
2. В сложных веществах отрицательную степень окисления имеют элементы с большей электроотрицательностью.
Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
+1 +7 -2
HClO4
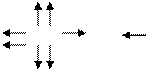 О-2
О-2
О-2 Cl 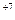 О-2 Н+ Элемент ЭО
О-2 Н+ Элемент ЭО
О-2 Н 2,1
Cl 3,0
О 3,5
В некоторых случаях степень окисления элемента численно совпадает с валентностью (В) элемента в данном соединении, как, например, в НClО4.
Приведенные ниже примеры показывают, что степень окисления и валентность элемента могут численно различаться:
N ≡ N В (N)=3; с.о.(N)=0
 Н+
Н+
Н+ C-2 О-2 Н+
Н+
ЭО (C) = 2,5 В(С) = 4 с.о.(С) = -2
ЭО (О) = 3,5 В(О) = 2 с.о.(О) = -2
ЭО (Н) = 2,1 В(Н) = 1 с.о.(Н) = +1
3. Различают высшую, низшую и промежуточные степени окисления.
Высшая степень окисления – это ее наибольшее положительное значение. Высшая степень окисления, как правило, равна номеру группы (N) периодической системы, в которой элемент находится. Например, для элементов III периода она равна: Na+2, Mg+2, AI+3, Si+4, P+5, S+6, CI+7. Исключение составляют фтор, кислород, гелий, неон, аргон, а также элементы подгруппы кобальта и никеля: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Низшая степень окисления определяется количеством электронов, не достающих до устойчивого состояния атома ns2nр6. Низшая степень окисления для неметаллов равна (N-8), где N – номер группы периодической системы, в которой элемент находится. Например, для неметаллов III периода она равна: Si-4, P-3, S-2,CI ˉ. Низшая степень окисления для металлов – это наименьшее ее положительное значение из возможных. Например, марганец имеет следующие степени окисления: Mn+2, Mn+4, Mn+6, Mn+7; с.о.=+2 – это низшая степень окисления для марганца.
Все остальные встречающиеся степени окисления элемента называют промежуточными. Например, для серы степень окисления, равная +4, является промежуточной.
4. Ряд элементов проявляют в сложных соединениях постоянную степень окисления:
а) щелочные металлы – (+1);
б) металлы второй группы обеих подгрупп (за исключением Нg) – (+2); ртуть может проявлять степени окисления (+1) и (+2);
в) металлы третьей группы, главной подгруппы – (+3), за исключением Tl, который может проявлять степени окисления (+1) и (+3);
г) F-
+1 -1 +2 -1
д) H+, кроме гидридов металлов (NaH, CaH2 и т.д.), где его степень окисления равна (-1);
+1 -1 +2 -1
е) О-2, за исключением пероксидов элементов (Н2О2, СаО2 и т.д.), где степень окисления кислорода равна (-1), надпероксидов элементов
+1 -1/2 +1 -1/2
(КО2, NaO2 и т.д.), в которых его степень окисления равна – ½, фторида
+2 -1
кислорода ОF2.
5. Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов.
В качестве примера вычислим степень окисления фосфора в ортофосфорной кислоте Н3РО4. Сумма всех степеней окисления в соединении должна быть равна нулю, поэтому обозначим степень окисления фосфора через Х и, умножив известные степени окисления водорода (+1) и кислорода (-2) на число их атомов в соединении, составим уравнение: (+1)*3+Х+(-2)*4 = 0, из которого Х = +5.
Вычислим степень окисления хрома в дихромат – ионе (Cr2О7)2-.
Сумма всех степеней окисления в сложном ионе должна быть равна (-2), поэтому обозначим степень окисления хрома через Х, составим уравнение 2Х +(-2)*7 = -2, из которого Х = +6.
Понятие степени окисления для большинства соединений имеет условный характер, т.к. не отражает реальный эффективный заряд атома. В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного
+1 -1 +2 -1 +3 -1
атома к другому: NaI ,MgCI2, AIF3. Для соединения с полярной ковалентной связью фактический эффективный заряд меньше степени окисления, однако это понятие весьма широко используется в химии.
Основные положения теории ОВР:
1. Окислением называют процесс отдачи электронов атомом, молекулой или ионом. Частицы, отдающие электроны, называют восстановителями; во время реакции они окисляются, образуя продукт окисления. При этом элементы, участвующие в окислении, повышают свою степень окисления. Например:
AI – 3e- ® AI3+
H2 – 2e- ® 2H+
Fe 2+ - e- ® Fe3+
2. Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Частицы, присоединяющие электроны, называют окислителями; во время реакции они восстанавливаются, образуя продукт восстановления. При этом элементы, участвующие в восстановлении, понижают свою степень окисления. Например:
S + 2e- ® S2-
CI2 + 2e- ® 2 CI ˉ
Fe3+ + e- ® Fe 2+
3.Вещества, содержащие частицы восстановители или окислители, соответственно называют восстановителями или окислителями. Например, FeCI2 является восстановителем за счет Fe2+, а FeCI3 - окислителем за счет Fe3+.
4. Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением. Таким образом ОВР представляют собой единство двух противоположенных процессов – окисления и восстановления
5. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Составление уравнений окислительно-восстановительных реакций. На последнем правиле базируются два метода составления уравнений для ОВР:
1. Метод электронного баланса .
Здесь подсчет числа присоединяемых и теряемых электронов производится на основании значений степеней окисления элементов до и после реакции. Обратимся к простейшему примеру:
Na0 + Cl  ® Na+ Cl
® Na+ Cl 
 |  |
| |
1 Cl2 + 2eˉ ® 2 Cl  - восстановление
- восстановление
 2 Na + Cl2 = 2Na+ + 2Cl
2 Na + Cl2 = 2Na+ + 2Cl 
2 Na + Cl2 = 2NaCl
Данный метод используют в том случае, если реакция протекает не в растворе (в газовой фазе, реакции термического разложения и т.д.).
2. Метод ионно-электронный (метод полуреакций).
Данный метод учитывает среду раствора, дает представление о характере частиц реально существующих и взаимодействующих в растворах. Остановимся на нем более подробно.
Алгоритм подбора коэффициентов ионно-электронным методом:
1. Составить молекулярную схему реакции с указанием исходных веществ и продуктов реакции.
2. Составить полную ионно-молекулярную схему реакции, записывая слабые электролиты, малорастворимые, нерастворимые и газообразные вещества в молекулярном виде, а сильные электролиты – в ионном.
3. Исключив из ионно-молекулярной схемы ионы, не изменяющиеся в результате реакции (без учета их количества), переписать схему в кратком ионно-молекулярном виде.
4. Отметить элементы, изменяющие в результате реакции степень окисления; найти окислитель, восстановитель, продукты восстановления, окисления.
5. Составить схемы полуреакций окисления и восстановления, для этого:
а) указать восстановитель и продукт окисления, окислитель и продукт восстановления;
б) уравнять число атомов каждого элемента в левой и правой частях полуреакций (выполнить баланс по элементам) в последовательности: элемент, изменяющий степень окисления, кислород, другие элементы; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы Н2О, ионы Н+ или ОН – в зависимости от характера среды:
| Процесс | Кислая среда | Нейтральная среда | Щелочная среда |
| Связывание избытка кислорода | О-2+2Н+ =Н2О | О-2+Н2О=2ОН ˉ | О-2+Н2О=2ОН ˉ |
| Восполнение недостатка кислорода | Н2О= О-2+2Н+ | Н2О = О-2+2Н+ | 2ОН ˉ=О-2+Н2О |
в) уравнять суммарное число зарядов в обеих частях полуреакций; для этого прибавить или отнять в левой части полуреакций необходимое число электронов (баланс по зарядам).
6. Найти наименьшее общее кратное (НОК) для числа отданных и полученных электронов.
7. Найти основные коэффициенты при каждой полуреакции. Для этого полученное в п.6 число (НОК) разделить на число электронов, фигурирующих в данной полуреакции.
8. Умножить полуреакции на полученные основные коэффициенты, сложить их между собой: левую часть с левой, правую – с правой (получить ионно-молекулярное уравнение реакции). При необходимости “привести подобные” ионы с учетом взаимодействия между ионами водорода и гидроксид-ионами: H++OH ˉ= H2O.
9. Расставить коэффициенты в молекулярном уравнении реакции.
10. Провести проверку по частицам, не участвующим в ОВР, исключенным из полной ионно-молекулярной схемы (п.3). При необходимости коэффициенты для них находят подбором.
11. Провести окончательную проверку по кислороду.
Примеры:
1. Кислая среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + H2O + K2SO4
Полная ионно-молекулярная схема реакции:
K++MnO  + Na++NO
+ Na++NO 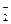 +2H++ SO
+2H++ SO  ® Mn2+ + SO
® Mn2+ + SO  + Na+ + NO
+ Na+ + NO 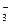 + H2O + 2K+ +SO
+ H2O + 2K+ +SO  .
.
Краткая ионно-молекулярная схема реакции:
+7 +3 +5
MnO 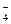 +NO
+NO 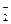 +2H+ ® Mn2+ + NO
+2H+ ® Mn2+ + NO 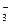 + H2O
+ H2O
ок-ль в-ль продукт в-ния продукт ок-ия
В ходе реакции степень окисления Mn понижается от +7 до +2 (марганец восстанавливается), следовательно, MnО 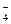 – окислитель; Mn2+ - продукт восстановления. Степень окисления азота повышается от +3 до +5 (азот окисляется), следовательно, NO
– окислитель; Mn2+ - продукт восстановления. Степень окисления азота повышается от +3 до +5 (азот окисляется), следовательно, NO 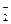 – восстановитель, NO
– восстановитель, NO 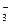 – продукт окисления.
– продукт окисления.
Уравнения полуреакций:

 2 MnO
2 MnO 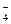 + 8H+ + 5e- ® Mn2+ + 4H2O - процесс восстановления
+ 8H+ + 5e- ® Mn2+ + 4H2O - процесс восстановления
10 +7 +(-5) = +2
5 NO 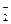 + H2O – 2e- ® NO
+ H2O – 2e- ® NO 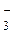 + 2H+ - процесс окисления
+ 2H+ - процесс окисления
-1 -(-2) = +1
 2MnO
2MnO 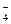 + 16H+ + 5NO
+ 16H+ + 5NO 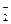 + 5H2O = 2Mn2+ +8H2O + 5NO
+ 5H2O = 2Mn2+ +8H2O + 5NO 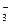 + 1OH+ (полное ионно-молекулярное уравнение).
+ 1OH+ (полное ионно-молекулярное уравнение).
В суммарном уравнении исключаем число одинаковых частиц, находящихся как в левой, так и в правой частях равенства (приводим подобные). В данном случае это ионы Н+ и Н2О .
Краткое ионно-молекулярное уравнение будет иметь вид
2MnO 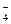 + 6H+ + 5NO
+ 6H+ + 5NO 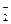 ® 2Mn2+ + 3H2O + 5NO
® 2Mn2+ + 3H2O + 5NO 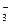 .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 5 NaNO2 + 3 H2SO4 = 2MnSO4+5NaNO3 + 3H2O + K2SO4.
Проверим баланс по частицам, которые не участвовали в ОВР:
K+ ( 2 = 2), Na+ (5 = 5), SO  (3 = 3). Баланс по кислороду: 30 = 30.
(3 = 3). Баланс по кислороду: 30 = 30.
2. Нейтральная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2O ® MnO2 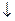 + NaNO3 + KOH
+ NaNO3 + KOH
Ионно-молекулярная схема реакции:
K+ + MnO 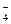 + Na+ + NO
+ Na+ + NO 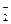 + H2O ® MnO2
+ H2O ® MnO2 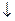 + Na+ + NO
+ Na+ + NO 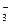 + K+ + OH
+ K+ + OH 
Краткая ионно-молекулярная схема:
+7 +3 +4 +5
MnO 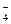 + NO
+ NO 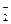 + H2O ® MnO2
+ H2O ® MnO2 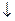 + NO
+ NO 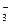 + OH-
+ OH-
ок-ль в-ль продукт в-ния продукт ок-ия

 Уравнения полуреакций:
Уравнения полуреакций:
 2 MnO
2 MnO 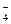 + 2H2O + 3eˉ ® MnO2
+ 2H2O + 3eˉ ® MnO2 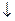 +4OH
+4OH  -процесс восстановления
-процесс восстановления
 6 -1 +(-3) = -4
6 -1 +(-3) = -4
3 NO 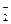 + H2O – 2eˉ ® NO
+ H2O – 2eˉ ® NO 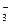 + 2H+ - процесс окисления
+ 2H+ - процесс окисления


 -1 - (-2) = +1
-1 - (-2) = +1
2MnO 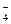 + 4H2O + 3NO
+ 4H2O + 3NO 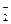 + 3 H2O ® 2MnO2
+ 3 H2O ® 2MnO2 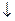
 + 8 OH- + 3NO
+ 8 OH- + 3NO 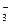 + 6H+.
+ 6H+.
Приводим подобные, учитывая:
8 ОН 
 + 6Н+ = 6Н2О + 2ОН
+ 6Н+ = 6Н2О + 2ОН  .
.
Краткое ионно-молекулярное уравнение:
2MnO 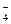 + 3NO
+ 3NO 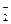 + H2O ® 2MnO2
+ H2O ® 2MnO2 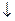 + 3 NO
+ 3 NO 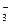 + 2OH
+ 2OH  .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 3NaNO2 + H2O ® 2MnO2 + 3NaNO3 + 2KOH.
Баланс по частицам, которые не участвовали в ОВР: Na+ (3 = 3); K+ ( 2 = 2). Баланс по кислороду: 15 = 15.
3. Щелочная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + KOH ® K2MnO4 + NaNO3 + H2O.
Ионно-молекулярная схема реакции:
K++MnO 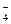 + Na++NO
+ Na++NO 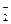 + K++ OH
+ K++ OH  ® 2K++MnO
® 2K++MnO  + Na++NO
+ Na++NO 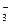 + H2O.
+ H2O.
Краткая ионно-молекулярная схема реакции:
+7 +3 +6 +5
MnO 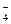 + NO
+ NO 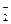 +OH
+OH  ® MnO
® MnO  + NO
+ NO 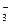 + H2O
+ H2O
oк-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:

 2 MnO
2 MnO 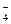 + 1e- ® MnO
+ 1e- ® MnO  – процесс восстановления
– процесс восстановления

 1 NO
1 NO 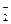 + 2OH
+ 2OH  - 2e- ® NO
- 2e- ® NO 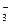 + H2O – процесс окисления
+ H2O – процесс окисления
 -3 - (-2) = -1
-3 - (-2) = -1
2 MnO 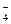 + NO
+ NO 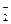 +2OH
+2OH  ® 2MnO
® 2MnO  + NO
+ NO 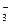 + H2O (краткое ионно-молекулярное уравнение).
+ H2O (краткое ионно-молекулярное уравнение).
В молекулярной форме уравнение имеет вид
2KMnO4 + NaNO2 + 2KOH ® 2K2MnO4 + NaNO3 + H2O
Баланс по частицам, которые не участвовали в ОВР: К+ (4 = 4); Na+ (1 = 1). Баланс по кислороду: 12 = 12.
| <== предыдущая страница | | | следующая страница ==> |
| Комплексные соединения. Комплексными называют соединения, в узлах кристаллов которых находятся комплексы (комплексные ионы) | | | Восстановители и окислители |
Дата добавления: 2014-09-29; просмотров: 402; Нарушение авторских прав

Мы поможем в написании ваших работ!