
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОБЩЕТЕОРЕТИЧЕСКИЕ ОСНОВЫ КУРСА
1.1. Агрегатные состояния
Состояние данной массы газа определяется тремя величинами (параметрами): давлением p, объемом V и температурой T. Эти величины связаны между собой функциональной зависимостью, которая может быть представлена соотношением f (p, V, T) = 0, называемым уравнением состояния. Уравнение состояния идеального газа выводится из трех законов – Бойля – Мариотта, Гей-Люссака и Авогадро. Реальные газы подчиняются этим законам тем точнее, чем меньше давление и выше температура [1].
Закон Бойля – Мариотта. При постоянной температуре объем данной массы обратно пропорционален давлению. Если V1 и V2 – объемы газа при давлении p1 и p2 соответственно, то
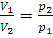
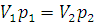 , или
, или 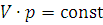 (1.1)
(1.1)
Из закона Бойля – Мариотта вытекает следствие: при постоянной температуре плотность газа ρ пропорционально его давлению:
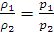 (1.1a)
(1.1a)
Законы Гей-Люссака и Шарля. При постоянном давлении с повышением температуры на 1°С объем данной массы газа увеличивается на 1/273,15 его объема при 0°С:
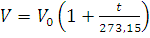 (1.2)
(1.2)
где V – объем газа при температуре t °С, а V0 – объем газа при 0°С.
При замене шкалы Цельсия абсолютной температурной шкалой (шкалой Кельвина), для которой T=273,15+t, этот закон можно сформулировать следующим образом: при постоянном давлении объем данной массы газа пропорционален его абсолютной температуре:
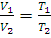 (1.3)
(1.3)
где V1 и V2 – объемы газа при абсолютных температурах T1 и T2
При постоянном объеме зависимость давления данной массы газа от температуры записывается уравнениями, аналогичными (1.2) и (1.3):
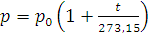 (1.4)
(1.4)
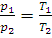 (1.5)
(1.5)
Объединенный закон Бойля – Мариотта – Гей-Люссака выражается уравнением:
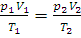 (1.6)
(1.6)
где p1 – давление и V1 – объем данной массы газа при абсолютной температуре T1, p2- давление и V2 – объем той же массы газа при абсолютной температуре T2.
Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится равное число молекул.
Число молекул (NA) в 1 моль вещества одинаково у всех веществ и равно 6,02·1023 (число Авогадро). Следовательно, количества веществ 1 моль, находящихся в газообразном состоянии при одинаковой температуре и одинаковом давлении, занимают равные объемы. При нормальных условиях (температура 0°С и давление = 1,01325·105 Па) объем 1 моль газа равен 22,414л.
Уравнение состояния идеального газа – уравнение Менделеева – Клайперона для одного моля газа имеет вид:
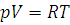 (1.7)
(1.7)
а для любого количества газообразного вещества:
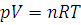 (1.8)
(1.8)
где R – универсальная газовая постоянная, числовое значение которой зависит от единиц измерения других величин. Величина ее выражается в единицах СИ Дж/(моль·К).
Уравнение (1.8) может быть использовано для определения относительной молекулярной массы Мч. Заменяя в нем величину n отношением m/M, где m – масса газа, а M – молярная масса данного газа, и решая его относительно M, получим:
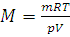 (1.9)
(1.9)
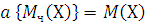
Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений составных частей (компонентов):
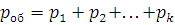 (1.10)
(1.10)
где pоб – общее давление смеси газов, p1, p2, pk – парциальные давления компонентов смеси. Парциальным давлением называется давление каждого компонента, если бы он один занимал объем, равный объему смеси той же температуре.
Уравнения (1.8) и (1.9) применимы к смесям газов, химически не взаимодействующих друг с другом, а также к каждому компоненту смеси. В первом случае n – общее количество вещества компонентов (n=n1+n2+…+nk=∑ni, где i=1, 2, …, k), M – средняя «смешанная» молярная масса, во втором случае n – количество вещества каждого компонента, т.е. n1, n2, …, nk, p – парциальное давление компонента, V – общий объем смеси.
Зависимость между парциальными давлениями и общим выражается уравнениями:
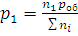 ,
, 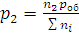 , …,
, …, 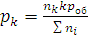 (1.11а)
(1.11а)
Отношения n1/∑ni, n2/∑ni, …, nk/∑ni, называют молярными долями данного компонента. Если молярную долю обозначить через x, то парциальное давление любого i-го компонента смеси (где i = 1, 2, …, k) будет равно:
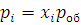 (1.11б)
(1.11б)
Таким образом, парциальное давление каждого компонента равно произведению его молярной доли на общее давление смеси.
Для идеальных газов молярная доля x равна объемной доле φ (V1/∑υi, V2/∑υi, …, Vk/∑υi). Если состав смеси выражен в объемных долях (%), то φ'
φ1'/100 = x1, φ2'/100 = x2, …, φk'/100 = xk, (1.12)
Кинетическая теория газов. Основным уравнением кинетической теории газов для 1 моль является уравнение:
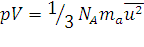 , (1.13)
, (1.13)
где ma – масса молекулы; ū – средняя квадратичная скорость молекул; NA – число молекул в 1 моль. Для любого количества вещества в уравнении вместо NA входит N.
Из основного уравнения кинетической теории газов можно вывести изложенные выше газовые законы и некоторые новые положения.
Сопоставляя уравнения (1.7) и (1.13) получим для 1 моль газа:
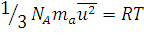 , (1.14)
, (1.14)
1. Отсюда находим среднюю квадратичную скорость молекул:
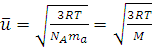 (1.15)
(1.15)
где M = NA·ma – молярная масса газа.
Из этого уравнения следует, что для одного и того же газа средняя квадратичная скорость молекул прямо пропорциональна корню квадратному из абсолютной температуры:
 (1.16)
(1.16)
где ū1 – средняя квадратичная скорость при температуре T1, а ū2 –то же самое при T2.
Для различных газов при одинаковой температуре средняя квадратичная скорость молекул обратно пропорциональна корню квадратному из относительных молекулярных масс:
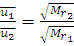 (1.17)
(1.17)
Здесь ū1 и 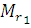 относятся к первому газу, а ū2 и
относятся к первому газу, а ū2 и 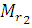 - ко второму.
- ко второму.
2. Из уравнения (1.14) находим:
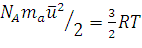 (1.18)
(1.18)
Выражение, стоящее в левой части этого равенства, есть средняя кинетическая энергия поступательного движения молекул идеального газа в количестве вещества 1 моль. Обозначив ее через Е, получим:
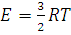 (1.19)
(1.19)
Разделив обе части уравнения (1.18) на NA, найдем, что средняя кинетическая энергия поступательного движения одной молекулы газа равна:
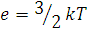 (1.20)
(1.20)
где 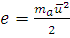 , а
, а 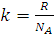 - константа, называемая постоянной Больцмана.
- константа, называемая постоянной Больцмана.
Следовательно, кинетическая энергия идеального газа пропорциональна абсолютной температуре.
Примеры
1. В баллоне емкостью 20 л находится водород под давлением 162·105 Па. Сколько шаров-пилотов можно наполнить водородом, если объем шара равен 200 л и давление в нем должно быть равно 2·105 Па? Водород при этих условиях считать идеальным газом.
Решение. Так как температура и масса газа остаются постоянными, то для решения задачи применим закон Бойля – Мариотта (1.1). После наполнения шаров-пилотов объем водорода (V2) буде равен:
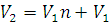
где V3 – объем одного шара; n – число шаров; V1 – объем баллона, в котором водород после наполнения последнего шара находится под давлением 2·105 Па. Заменив в уравнении (1.1) V2 его значением, получим:
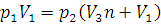
Отсюда
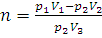
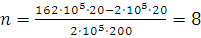
Находим, что водородом можно наполнить восемь шаров-пилотов.
2. При нормальных условиях плотность азота равна 1,25 г/л. Определить плотность газа при 0°С и давлении 5,065·105 Па.
Решение. Требуется определить плотность азота при 0°С и давлении 5,065·105 Па. Из уравнения (I, 1а) находим ρ2 – плотность при давлении p2:
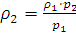 ;
; 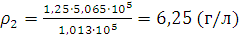
3. При постоянном давлении открытая двухлитровая колба охлаждается от 200 до 0°С. Насколько увеличится масса воздуха в колбе, если плотность воздуха при нормальных условиях равна 1,293 г/л? Изменением объема колбы вследствие охлаждения стекла пренебречь.
Решение. Объем одного и того же количества газа согласно закону Гей-Люссака при 0°С должен быть меньше, чем при 200°С. Если при t2 = 0°С его объем V2 = 2 л, то при t1 = 200°Сон может быть определен из уравнения (1.3):
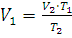 ;
; 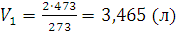
При 0°С масса газа в двухлитровой колбе равна 1,293x2=2,586 (г). При 200°С такую же массу будет иметь 3,465 л. Таким образом, если температура понизится с 200°С до 0°С, то в колбу войдет 3,465-2=1,465 (л) воздуха; соответствующая масса может быть определена из пропорции:
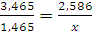 ;
; 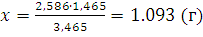
Следовательно, масса газа в колбе увеличится на 1,093 г.
4. Смесь эквивалентных количеств этана и кислорода находится в замкнутом сосуде при температуре 15°С и давлении 1·105 Па. Каково будет давление после взрыва смеси и приведения содержимого сосуда к первоначальной температуре?
Решение. Напишем уравнение реакции горения этана:
2С2Н6 + 7О2 = 4СО2 + 6Н2О
Вода при температуре 15°С будет в жидком состоянии, и при подсчета числа молекул не нужно учитывать образовавшихся молекул воды (так как объем жидкости по сравнению с объемом газа той же массы несоизмеримо мал). Из уравнения следует, что из 9 молекул исходных веществ образовалось 4 молекулы. Так как объем газов и температура остаются постоянными, то с уменьшением числа молекул в 9/4 раза и давление должно уменьшиться в такое же число раз, т.е. оно будет равно: 1·105:9/4=0,4·105 Па.
5. Для хлорирования питьевой воды хлор доставляется в баллонах под давлением. Давление в этих баллонах равно ,722·105 Па при 0°С и 15,47·105 Па при 30°С. Можно ли считать хлор в этих условиях идеальным газом?
Решение. Так как в баллоне объем постоянен, то для идеального газа, как следует из уравнения (I, 5),  - величина постоянная. Вычисляем это отношение для хлора: при 0°С
- величина постоянная. Вычисляем это отношение для хлора: при 0°С 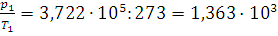 , а при 30°С
, а при 30°С 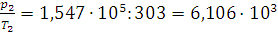 . Оно непостоянно. Следовательно, хлор в этих условиях считать идеальным газом нельзя.
. Оно непостоянно. Следовательно, хлор в этих условиях считать идеальным газом нельзя.
6. При температуре 18°С и давлении 98,64 кПа объем газа равен 2 л. Привести объем газа к равным нормальным условиям.
Решение. Из уравнения (1.6) находим V1 – объем при нормальном давлении 1,013·105 Па и температуре 273 К. Данные задачи переводим в единицы СИ:
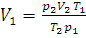 ;
; 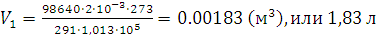
7. Вычислить при нормальных условиях газовую постоянную R, выразив ее в: а) Па·м3/(моль·К); б) Дж/(моль·К).
Решение. Из уравнения (1.7) находим: 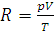 . Подставляем в эту формулу числовые значения: p=1.01325·105Па, Т-273,15 К и Vm=2,2414·10-2 м3 (молярный объем газа):
. Подставляем в эту формулу числовые значения: p=1.01325·105Па, Т-273,15 К и Vm=2,2414·10-2 м3 (молярный объем газа):
а) 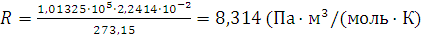 ;
;
б) 8,314 Па·м3/(моль·К) = 8,314 Н/м2 · м3/(моль·К) = 8,314 Дж/(моль·К).
8. Какое количество вещества и какая масса кислорода находится в газометре емкостью 10 л при 20°С и под давлением 100 кПа?
Решение. Решаем уравнение (1.8) относительно n: 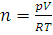 . Данные задач подставляем в уравнение в единицах СИ: R=8,314 Дж/(моль·К), p=1·105 Па, Т=273+20=293 К, V=0,01 м3:
. Данные задач подставляем в уравнение в единицах СИ: R=8,314 Дж/(моль·К), p=1·105 Па, Т=273+20=293 К, V=0,01 м3:
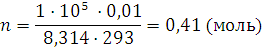
m = nM ; m = 0,41 · 32 = 13,12 (г)
9. По методу В. Майера определялась относительная молекулярная масса этилового эфира. При испарении эфира массой 0,0856 г его пары вытеснили в эвдиометрическую трубку воздух объемом 29,2 мл; высота водяного столба в эвдиометрической трубке 22,5 см, температура воздуха 17°С, атмосферное давление 1005 гПа. Давление насыщенного пара воды при 17°С равно 19,37гПа. Вычислить относительную молекулярную массу эфира и найти относительную ошибку опыта в процентах.
Решение. Давление сухого воздуха, заключенного в эвдиометрической трубке, будет равно:
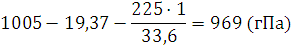
где 1 – значение плотности воды и 13,6 – значение плотности ртути. Подставляем в уравнение (I, 9) соответствующие значения, выразив их в единицах СИ, получаем:
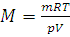 ;
; 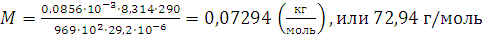
Таким образом, относительная молекулярная масса эфира равна 72,94. Относительная ошибка в процентах равна:
(74,08-72,94)·100:74,08-1,54 %
где 74,08 – табличная величина относительной молекулярной массы эфира.
10. Смешаны водород объемом 3 л и под давлением 2·105 Па с кислородом объемом 2 л под давлением 1·105 Па. Общий объем смеси равен 4 л. Определить парциальные давления газов и общее давление смеси.
Решение. Водород, занимавший объем V1, равный 3 л, при давлении p1 равном 2·105 Па, после смешивания с кислородом распространится в объеме V2, равном 4 л. Парциальное давление водорода , равное p2, находим из закона Бойля – Мариотта (1.1):
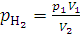 ;
; 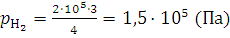 .
.
Парциальное давление кислорода находим аналогичным способом:
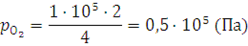
Общее давление p смеси равно: 1,5·105 + 0,5·105 = 2·105 (Па).
11. Смесь из 2 моль азота, 3 моль кислорода и некоторого количества вещества аммиака при 20°С и давлении 4·105 Па занимает объем 40 дм3. Вычислить количество аммиака в смеси и парциальное давление каждого из газов.
Решение. Из уравнения (1.8) находим n – общее количество всех газообразных веществ, составляющих смесь, и подставляем R, равное 8,314 Дж/(моль·К), p = 4·105 Па, V = 4·10-2 м3, T =273+20 = 293 К :
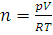 ;
;
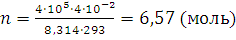
Количество вещества аммиака
n (NH3) = 6,57 – 2 – 3 = 1,57 (моль)
Парциальное давление газов вычисляем по уравнению (1.11а):
p (N2) = 4·105 · 2 : 6,57 = 1,217·105 (Па);
p (O2) = 4·105 · 3 : 6,57 =1,826·105 (Па);
p (NH3) = 4 · 105 · 1,57 : 6,57 =0,956·105 (Па).
12. 0,5 моль водорода и 0,25 моль азота находятся в газометре вместимостью 5 л при 10°С. Вычислить парциальное давление каждого из газов и состав смеси в объемных долях.
Решение. Парциальное давление каждого компонента находим из уравнения (1.8):
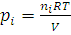 ;
;
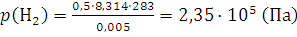
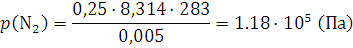
По формуле (1.12) вычисляем содержание водорода и азота в объемных долях:
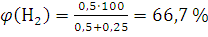 ;
;
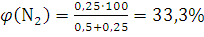
13. Какое давление будет иметь при 0°С кислород объемом 10 л и количеством вещества 0,25 моль? Средняя квадратичная скорость молекул кислорода при этой температуре равна 461 м/с.
Решение. Из формулы (1.13) находим давление, подставляя значения в единицах СИ: 10 л равны 0,01 м3, масса газа (N·ma) равна произведению молярной массы на количество вещества, т.е. 0,032 кг/моль · 0,25 моль = 0,008 кг:
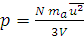 ;
; 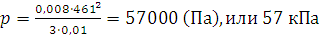
14. При какой температуре средняя квадратичная скорость молекул хлора будет равна 500 м/с?
Решение. Из формулы (1.14) находим T:
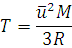
Подставляем значения, выражая их в СИ: ū в м/с, М в кг/моль, а R в Дж/(моль·К), и получаем:
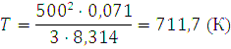
Следовательно, температура t будет равна:
711,7 – 273 = 483,7 (°С)
1.2. Химическая термодинамика
1.2.1. Первый закон термодинамики
Первый закон термодинамики есть закон сохранения энергии в применении его к термодинамическим процессам. Можно дать несколько, по существу равноценных, формулировок этого закона:
а) общая энергия изолированной системы остается постоянной независимо от каких бы то ни было изменений, происходящих в этой системе;
б) изменение внутренней энергии системы (∆U) равно разности между количеством сообщенной системе теплоты q и количеством работы А, совершенной системой.
Математическое выражение первого закона термодинамики будет иметь вид:
∆U = q - A (2.1)
q - считается положительной, если теплота поглощается системой, и отрицательной, если теплота выделяется [2].
Из первого закона термодинамики вытекает ряд следствий, имеющих большое значение для физической химии и решения различных технологических задач. Мы ограничимся применением первого закона термодинамики только для идеальных газов и рассмотрим важнейшие процессы: изохорический, изобарический, изотермический и адиабатический.
Изохорический процесс
Изохорический процесс протекает при постоянном объеме, поэтому система никакой работы не совершает. В этом случае вся теплота расходуется на увеличение внутренней энергии системы. Если V - соnst, то A=0, тогда
qV = ∆U
При изохорическом процессе количество теплоты, получаемое системой, можно вычислить по уравнениям:
qV = пСV(Т2 – T1); (2.2)
qV=nCvT1/T2(p2–p1) (2.3)
гдеn — количество вещества; р1 и р2 — соответственно начальное и конечное давление системы; — молярная теплоемкость при постоянном объеме; T1 — начальная температура; T2 — конечная температура.
Изобарический процесс
Если теплота поглощается системойпри постоянном давлении, то в системе соответственно увеличивается энтальпия. Если р = const, то
∆U = qp - А, но ∆U + А = ∆H. Тогда qp = ∆H (2.4)
Количество теплоты, получаемое системой в этих условиях, может быть вычислено по уравнениям:
qр = nСр (Т2 – T1), (2.5)
qp = 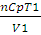 (V2 –V1) (2.6)
(V2 –V1) (2.6)
где Ср — молярная теплоемкость при постоянном давлении; V1 и V2 -соответственно начальный и конечный объем системы.
Работа при изобарическом процессе выражается уравнением:
A=р(V2 - V1) (2.7)
Изотермический процесс
Если совершается изотермический процесс, то внутренняя энергия системы при этом не меняется. Вся сообщаемая теплота расходуется на работу по расширению системы.
Если T = сonst, то ∆U = 0, тогда q = A.
Работа изотермического расширения системы может быть вычислена по уравнениям:
А = nRТ -2,3 lg 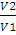 ; (2.8)
; (2.8)
A = nRТ -2,3 lg 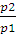 (2.9)
(2.9)
Адиабатический процесс
При адиабатическом процессе теплообмен между данной системой и окружающей средой отсутствует, поэтому q = 0. При этом система может совершать работу только за счет убыли внутренней энергии: А = -∆U. Работа в этом случае может быть вычислена по одному из следующих уравнений:
A= пСv(T1— T2), (2.10)
A = 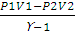 , (2.11)
, (2.11)
A = 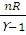 (T1 – T2), (2.12)
(T1 – T2), (2.12)
ϒ = 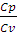 (2.13)
(2.13)
Связь между давлением, объемом и температурой в начале и конце адиабатического процесса выражается уравнениями:
p1V1ϒ = p2V2ϒ; (2.14)
T1V1ϒ-1 = T2V2ϒ-1; (2.15)
Для одноатомных газов
Cv =  R, а Cp =
R, а Cp =  R (2.16)
R (2.16)
Следовательно,
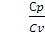 = ϒ; ϒ = 1,67 (2.17)
= ϒ; ϒ = 1,67 (2.17)
Для двухатомных газов
Cv =  R, a Cp =
R, a Cp =  R (2.18)
R (2.18)
Отсюда
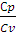 = ϒ = 1,40 (2.19)
= ϒ = 1,40 (2.19)
Примеры
1. Путем нагревания при постоянном давлении в 1,013∙105 Па газу сообщено 2093,4 Дж теплоты. Определить изменение внутренней энергии этого газа, если он при этом расширился от 0,01 до 0,02 м3.
Решение: Согласно первому закону термодинамики ∆U = q - А. Работа, совершенная газом при изобарическом расширении, может быть вычислена по уравнению (2.7):
А = р (V2 — V1);
А = 1,013 . 105 Па • (0,02 м3 - 0,01 м3) = 1013 Дж
Отсюда ∆U = 2093,4 - 1013 = 1080,4 (Дж).
2. Гелий массой 75 г нагревали при температуре 100 °С и давлении 1,013 • 105 Па. Вычислить количество затраченной теплоты, если объем газа изменился от 3 до 15 л.
Решение: Так как нагревание газа происходит изотермически и изобарически, то количество затраченной теплоты можно вычислить по уравнению (2.6), только дополнительно необходимо определить количество вещества п и молярную теплоемкость гелия при постоянном давлении:
n (Не) = 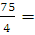 18,75 (моль)
18,75 (моль)
Гелий — одноатомный газ, поэтому согласно формуле (2.16)
Ср =  • 8,314 = 20,79 (Дж/моль);
• 8,314 = 20,79 (Дж/моль);
qp = 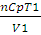 (V2 – V1)
(V2 – V1)
qp = 18,75•20,79•373/3• (15 – 3) = 581600 (Дж) или 582 кДж
3. Определить работу, совершаемую азотом при изотермическом (20 ºС) расширении его от 0,015 до 0,1 м3, если начальное давление было 3,039 • 105 Па. Каково будет конечное давление?
Решение. Для изотермического процесса работа расширения газа может быть вычислена по уравнению (2.8). Количество вещества азота находим из уравнения состояния идеального газа:
pV = nRТ;
n(N2) = 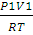 ;
;
n(N2) = 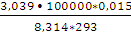 = 1,875 (моль)
= 1,875 (моль)
А = пКТ • 2,3lg 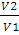 ;
;
А= 1,875 • 8,314 • 293 • 2,3 lg 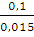 = 8657 (Дж)
= 8657 (Дж)
Конечное давление газа при постоянной температуре и известном объеме находим по закону Бойля — Мариотта:
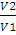 =
= 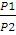
Отсюда
p2 = 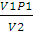 ;
;
p2 = 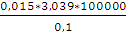 = 45600 (Па)
= 45600 (Па)
4. Сколько нужно затратить теплоты, чтобы изохорически нагреть кислород массой 25 г от 0 до 50 °С?
Решение. При изохорическом процессе газ никакой работы не совершает, поэтому вся подводимая к газу теплота расходуется на его нагревание. Согласно уравнению (2.2)
qv = nCv(T2 – T1); п (02) = 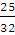 = 0,781 (моль)
= 0,781 (моль)
Для двухатомного газа
Cv =  R
R
С = 2,5 • 8,314 = 20,79 (Дж);
qv = 0,781 • 20,79 • (323 — 273) = 812 (Дж)
5. Навеску водорода массой 0,5 г, взятую при 25 °С, адиабатически сжимают от 6 до 2 л. Определить конечную температуру газа и работу, затраченную на его сжатие.
Решение. Связь между объемом и температурой адиабатического процесса показывает уравнение (2.14):
T1V1ϒ-1 = T2V1ϒ-1
Для двухатомного газа ϒ = 1,40. Из уравнения (2.14) находим Т2:
Т2 = 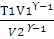 ; T2 =
; T2 = 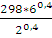
lgT2 = lg 298 + 0,4lg 6 – 0,4lg2 = 2,6651;
T2 = 462,5K
Для определения затраченной работы применим уравнение (2.10):
А = пСv (T1 — T2); п (Н2) = 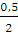 = 0,25 (моль)
= 0,25 (моль)
Для двухатомного газа Сv = 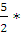 8,314 = 20,79 (Дж);
8,314 = 20,79 (Дж);
А = 0,25 • 20,79 • (298 — 462,5) = -855 (Дж)
1.2.2. Термохимия
Тепловым эффектом реакции называют теплоту, выделенную или поглощенную в ходе химической реакции, протекающей необратимо при постоянном давлении или постоянном объеме, причем температура исходных веществ (исх) и продуктов реакции (прод) одна и та же. В термодинамике положительной считают ту теплоту, которую подводят к системе (эта теплота поглощается системой), а отрицательной - ту, которую система выделяет. В термохимии приняты обратные обозначения.
Тепловой эффект химической реакции относят обычно к 1 моль образовавшегося вещества (обр). С этой целью нередко в термохимических уравнениях коэффициенты следует брать дробными.
Из первого закона термодинамики (2.1) следует: qv = ∆U; qv = ∆H. Таким образом, тепловой эффект химической реакции при постоянном объеме представляет собой изменение внутренней энергии системы ∆U , а при постоянном давлении — изменение энтальпии ∆H . Разница между∆H и ∆U мала, если реакция идет между жидкими или твердыми веществами. В случае реакций с участием газообразных веществ это различие заметно. Если в реакции участвует п1 моль, а получается п2 моль газообразных веществ, то
∆H = ∆U +RT (n2 — n1) (2.20)
В термохимии чаще имеют дело с ∆Н.
Основным законом термохимии является закон Гесса (1840) — частный случай первого закона термодинамики: если процесс идет при постоянном давлении или при постоянном объеме, то тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает. Из закона Гесса вытекают следствия:
1. Тепловой эффект химической реакции равен разности между суммой теплот образования получающихся веществ и суммой теплот образования вступающих в реакцию веществ (с учетом их стехио- метрических коэффициентов):
∆Нреакц = ∑(∆Нобр)прод - ∑(∆Н обр)исх (2. 21)
2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания (сгор) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом их стехиометрических коэффициентов):
∆Нреакц = ∑(∆Hсгор)исх - ∑(∆Hсгор)прод (2.22)
Величины стандартных теплот образования и теплот сгорания находят в справочниках. Значение закона Гесса состоит в том, что он позволяет определить тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто, т. е. без побочных процессов [2].
При растворении кристаллогидратов наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Разность между теплотой растворения безводной соли ∆Hбезв и теплотой растворения ее кристаллогидрата ∆Hкр есть теплота гидратации ∆Hгидр:
∆Нгидр = ∆Нбезв - ∆Нкр (2.23)
Примеры
1. Реакция горения ацетилена при стандартных условиях выражается уравнением:
С2Н2 + 2  02 = 2С02+ Н2Ож, ∆Н = -1300 кДж
02 = 2С02+ Н2Ож, ∆Н = -1300 кДж
Определить теплоту образования ацетилена при постоянном давлении.
Решение. Для решения задачи данный химический процесс следует разбить на отдельные промежуточные стадии:
1) разложение ацетилена на углерод и водород:
С2Н2 = 2С + Н2 + ∆ Нх
2) образование углекислого газа из углерода и кислорода:
2С + 202 = 2С02 - 2 • 393,77 кДж
3) образование жидкой воды из водорода и кислорода:
Н2 +  02 = Н2Ож - 285,96 кДж
02 = Н2Ож - 285,96 кДж
Сумма тепловых эффектов всех стадий этого процесса и должна равняться общему тепловому эффекту горения ацетилена:
∆ Нх - 787,54 - 285,96 = - 1300
∆Нх = -226,5 кДж, ∆Нх - теплота разложения ацетилена; следовательно, теплота образования ацетилена при стандартных условиях ∆Нº298 равна 226,5 кДж.
Теплоту образования ацетилена также можно определить, используя следствие из закона Гесса (2.21), т. е. теплота горения ацетилена будет равна сумме теплот образования 2 моль углекислого газа и 1 моль воды (жидкой) минус теплота образования 1 моль ацетилена:
-2 • 393,77 - 285,96 - ∆Нº298 = -1300;
∆Нº298 = 226,5 кДж
2. Процесс алюминотермии выражается химическим уравнением:
8А1 + ЗFe304 = 4А1203 + 9Fe + ∆Н
Рассчитать, сколько выделится теплоты при сгорании 1 кг термита.
Решение. По теплотам образования участвующих в реакции веществ определим тепловой эффект реакции в целом. Для этого рассмотрим отдельно каждую стадию процесса:
1) ЗFе304 = 9Fе + 602 + 3 • 1117,82 кДж;
2) 8А1 + 602 - 4А1203 - 4 • 1670,5 кДж.
Алгебраическая сумма всех стадий процесса и будет составлять тепловой эффект реакции:
∆H = 3 • 1117,82 — 4 • 1670,5 = -3328,5 кДж
Из уравнения реакции следует, что 3328, 5 кДж теплоты выделяется при взаимодействии алюминия массой 216 г (8 • 27) и магнетита массой 696 г (3 • 232), т. е. при сгорании термита массой 912 г. При сгорании термита массой 1000 г выделится х кДж:
912 : 1000 = -3328,5 : х; х = -365 (кДж)
3. Вычислить тепловой эффект при постоянном давлении и постоянном объеме в стандартных условиях реакции:
С2Н5ОНж + 02 = СН3СООНж + Н2Ож
Решение. Тепловой эффект реакции может быть рассчитан по теплотам образования участвующих в реакции веществ (2.21). Но в данном случае удобнее его рассчитать по тепловым эффектам сгорания (2.22). В справочнике находим тепловые эффекты полного сгорания всех реагирующих веществ в кислороде. Теплота сгорания этилового спирта равна — 1367,7 кДж. Теплота сгорания СН3СООНж равна — 872,1 кДж. Теплота сгорания Н2Ож равна нулю, так как она высший оксид, продукт полного сгорания водорода в кислороде:
∆Нреакц = - 1367,7 - (-872,1) = - 495,6 (кДж/моль)
∆Uº289 рассчитываем по уравнению (2.20), но предварительно килоджоули переведем в джоули:
∆Uº289 = -495600 – 8,314 • 298 • (0 - 1); ∆Uº289 = - 493 (кДж)
4. На сколько градусов повысится температура при растворении 0,5 моль серной кислоты в воде массой 400 г, если теплота растворения серной кислоты равна — 74,94 кДж, а удельная теплоемкость раствора равна 3,77 Дж/(г • К)?
Решение. 74 940 Дж выделяются при растворении 1 моль кислоты. При растворении же 0,5 моль серной кислоты массой 49 г в воде массой 400 г образуется раствор массой 449 г и выделится 37 470 Дж (74 940 • 0,5). 3,77 Дж нагревают раствор массой 1 г на 1 °С, а 37 470 Дж нагревают на ∆t:
449 • 3,77 • ∆t = 37 470. Отсюда ∆t = 22,14 °С.
5. При растворении сульфата меди массой 8 г в воде массой
192 г температура повышается на 3,95 °С. Определить теплоту гидратации сульфата меди СuS04, если известно, что теплота растворения СuS04,• 5Н20 равна 11 723 Дж. Удельная теплоемкость раствора равна 4,187 Дж/(г • К).
Решение. Для нагревания раствора массой 1 г на 1 °С потребуется 4,187 Дж, а для нагревания раствора массой 200 г (8 + 192) на 3,95 °С потребуется:
4,187 • 200 • 3,95 = 3308 (Дж)
Следовательно, при растворении сульфата меди массой 8 г в воде массой 192 г выделяется 3308 Дж, а при растворении 1 моль (160 г) безводной соли выделится ∆Hбезв.
Тогда 8:160 = -3308:∆Hбезв;
∆Hбезв= -66160 (Дж).
Из уравнения (2.23) находим теплоту гидратации:
∆Нгидр = 66160 - 11723 = - 77 883 (Дж)
1.2.3. Второй закон термодинамики
Согласно второму закону термодинамики теплота самопроизвольно может переходить только от более нагретого тела к менее нагретому. Установлено, что в работу может превращаться только часть той теплоты, которая переходит от нагревателя к холодильнику, и тем большая, чем больше разность температур:
A = q 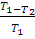 (2. 24)
(2. 24)
где q - теплота, отдаваемая нагревателем; T1—температура нагревателя; Т2 — температура холодильника.
Отношение  называется коэффициентом полезного действия (КПД) - η. Отсюда
называется коэффициентом полезного действия (КПД) - η. Отсюда
η = 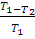 (2.25)
(2.25)
На основе второго закона термодинамики Клаузиус ввел понятие энтропии S — термодинамической функции системы. Изменение энтропии ∆S в каком-либо процессе зависит только от начального и конечного состояний системы и не зависит от пути перехода.
Наиболее просто ∆S определяется для обратимых неизолированных изотермических процессов:
∆S =  (2.26)
(2.26)
где q — количество теплоты, сообщенное системе.
При изотермическом плавлении или испарении количества вещества 1 моль: ∆S = ∆H/T
где ∆H - теплота плавления или теплота испарения.
Если происходит изотермическое расширение п моль идеального газа, то
∆S =nR • 2,3lgV2/V1 (2.28)
∆S = nR2,31gp1/p2 (2.29)
Если же в системе, состоящей из идеального газа, изменяется одновременно несколько параметров, то
∆S = пСv . 2,3lgT2/T1+ пR • 2,3 lgV2/V1 (2.30)
∆S = пСp • 2,3lgT2/T1 + пR ∙2,3lg p1/p2 (2.31)
∆S = п • 2,3(Cvlg p2/p1 + Cplg(V2/V1) (2.32)
Вычисление ∆S в необратимых процессах ведут по уравнениям для процессов обратимых. Это вполне закономерно, так как изменение энтропии при заданном начальном и конечном состояниях системы не зависит от пути перехода и, в частности, от обратимости процесса. Если необратимый и обратимый процессы проводятся в одних и тех же граничных условиях, то
∆Soбр =∆S неoбр.[2].
Примеры
1. К котлу с водой, находящейся при 100 °С, подвели 8374 Дж теплоты. Найти КПД и максимальную работу, которую можно получить от котла, если температура холодильника 30 °С.
Решение. Максимальную работу находим по уравнению (2.24):
А = q(T1 – T2/T1);
A = 8374 • (373 – 303)/373 = 1571 (Дж)
Согласно уравнению (2.25)
η = 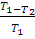 ;
;
η = 373-303/373 = 0,1875, или 18,75 %
2. При временном контакте тела с температурой 200 °С с телом, нагретым до 100 °С, перешло 418,7 Дж теплоты. Найти общее изменение энтропии системы.
Решение. Изменение энтропии теплоотдатчика и теплоприемника находим по уравнению (2.26):
∆S1 =q/T;
∆S1 = -418,7/473 = - 0,885 (Дж)
∆S2 = 418,7/373 = 1,122 (Дж)
Находим общее изменение энтропии:
∆S = ∆S1 +∆S2; ∆S = -0,885+1,122 = 0,237 (Дж)
3. Азот объемом 0,001 м3 смешан с кислородом объемом 0,002 м3 при 27 °С и давлении 1,013 • 105 Па. Найти общее изменение энтропии системы.
Решение. При смешении газы будут диффундировать друг в друга. Межмолекулярным взаимодействием газов можно пренебречь, так как при данных условиях газы можно принять за идеальные. Поэтому общее изменение энтропии при смешении газов будет равно сумме изменений энтропий каждого газа при его расширении до объема смеси. Так как процесс изотермический, то из уравнения (1.28) для каждого газа
Из уравнения (1.8) n =pv/RT;
n(N2) = 0,001•1,013•105 = 0,0405;
n(O2) = 0,002•1,013•105/8,314•300 = 0,081;
∆S(N2) = 0,0405 • 8,314 • 2,3lg(0,003/0,001) = 0,371 (Дж)
∆S(O2) = 0,081• 8,314 • 2,3lg(0,003/0,002) = 0,274 (Дж)
∆S = 0,371 + 0,274 = 0,645 (Дж)
Эта задача может быть решена и по уравнению (2.29), нужно только по уравнению (2.11б) найти парциальные давления газов:
p(N2) = pоб 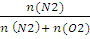 ;
;
p(N2) = 1,013 • 105 +0,0405/0,0405 + 0,081 = 0,337 * 105 (Па);
p(O2) = 1.013•105 – 0,337•105=0,676•105 (Па);
∆S(N2) = 0,0405•8,314•2,3lg(1,013•105/0,337•105)=0,371 (Дж);
∆S(O2) = 0,081•8,314•2,3lg(1,013•105/0,676•105)=0,274 (Дж);
∆S = 0,371+0,274=0,645 (Дж);
4. Вода массой 1 кг, взятая при 0 °С, переведена в состояние перегретого пара с температурой 200 °С и давлением 101,3 кПа. Вычислить изменение энтропии этого перехода, если удельная теплота испарения воды при 100 °С равна 2257 Дж/г, удельная теплоемкость воды равна 4,187 Дж (г•К), а удельная теплоемкость водяного пара при давлении в 1,013 • 105 Па равна 1,968 Дж (г•К).
Решение. Общее изменение энтропии будет складываться из трех составляющих: изменения энтропии ∆S1 при нагревании воды до температуры кипения, изменения энтропии ∆S2 при переходе воды из жидкого состояния в парообразное и, наконец, изменения энтропии ∆S3 при нагревании сухого пара от 100 до 200 °С: ∆S = ∆S1+∆S2 + ∆S3
∆S1 определяем по уравнению ∆S = пСр • 2,3lg(T2/T1) —. Оно получено из уравнения (II, 31), если предположить, что система подчиняется законам для идеальных газов и что объем воды при нагревании не изменяется. Молярная теплоемкость Ср равна удельной теплоемкости, умноженной на молярную массу: Ср = 4,187 • 18 = 75,4 (Дж/(моль • К);
п (Н20) = 1000 : 18 = 55,6 моль;
∆S1 = 55,6 • 75,4 • 2,3lg(373/273) = 1305,5 (Дж)
∆S2 находим по уравнению (II, 27). Молярная теплота испарения равна:
∆Hисп = 2256,7 • 18 = 40 620 (Дж/моль);
∆S2 = ∆Hисп/T; ∆S2 = 55,6 • 40 620/373 = 6065 (Дж)
При нагревании сухого пара от 100 до 200 °С при постоянном давлении изменение энтропии равно: ∆S3 = пСр • 2,3lg(T2/T1). Молярная теплоемкость пара Ср = 1,968 • 18 = 35,42 (Дж/моль).
∆S3 = 55,6 • 35,42 • 2,3lg(473/373) = 464,3 (Дж);
∆S = 1303,5 + 6055 + 464,3 = 7824,8 (Дж)
| <== предыдущая страница | | | следующая страница ==> |
| ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ РАЗВИТИЯ И ТУШЕНИЯ ПОЖАРОВ | | | ГОРЕНИЕ КАК ФИЗИЧЕСКОЕ ЯВЛЕНИЕ. ОСНОВНЫЕ ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ |
Дата добавления: 2014-10-14; просмотров: 1029; Нарушение авторских прав

Мы поможем в написании ваших работ!