
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
баллов отлично
11,5 - 10 баллов хорошо
9,5 – 8,5 баллов удовлетв.
8 - 0 баллов неудовлетв.
Если студент набрал 8 баллов и меньше, то считается, что он не сдал экзамен по общей и неорганической химии и ему в экзаменационную ведомость выставляется оценка «неудовлетворительно» (т.е. «2»).
III этап. Решение ситуационных задач
КРИТЕРИИ ОЦЕНОК
Оценка «ОТЛИЧНО» выставляется за полные и правильные ответы на все вопросы билета. Допустимое число незначительных замечаний и недочетов – не более двух. При ответе необходимо использовать всю рекомендованную литературу.
Оценка «ХОРОШО» выставляется за правильные, но недостаточно полные ответы на все вопросы билета, при наличии 1 грубой ошибки или 3-4 незначительных замечаний (недочетов).
Оценка «УДОВЛЕТВОРИТЕЛЬНО» выставляется за неполные, неточные ответы на все вопросы билета, при наличии двух грубых ошибок или пяти незначительных замечаний (недочетов).
Оценка «НЕУДОВЛЕТВОРИТЕЛЬНО» выставляется:
1) за полное отсутствие ответа на два из вопросов при достаточно полном и правильном ответе на другой вопрос билета;
2) за неполные, неточные ответы на все вопросы билета, если они содержат более двух грубых ошибок или более пяти незначительных замечаний (недочетов);
3) при обнаружении шпаргалок.
КРИТЕРИИ
выставления итоговой оценки за экзамен
по общей и неорганической химии
Оценка за весь экзамен по общей и неорганической химии выводится из: двух положительных оценок, полученных на II и III этапах экзамена.
При отказе отвечать на III – м этапе и полном отсутствии правильных ответов на все вопросы 3-го этапа экзамена за экзамен по общей и неорганической химии ставится оценка «неудовлетворительно».
Темы для УИРС
1. Комплексоны и их использование в медицине при различных патологиях.
2. Использование комплексонов при очистке воды.
3. Комплексные соединения в организме человека.
1. Оценочные средства для текущего и рубежного контроля успеваемости.
Примеры заданий в тестовой форме для текущего контроля
Задание: Укажите один или несколько вариантов правильных ответов.
1.Какие кислоты взаимодействуют с цинком с выделением водорода:
а) НС1р
б) H2S04k
в) HN03 з,з%
г) СН3СООН
2. В каких реакциях водород проявляет свойства окислителя:
а) Н2+С12
б) Na+H2
в) Са+Н2
г) MgO+H2
3. Укажите вещество с ковалентной неполярной связью:
а) Н2
б) NH3
в) LiH
г) Н20
4. Какие реакции используются для получения пероксида водорода:
а) Na2О2 + H2SО4
б) BaO + H2SО4
в) ВаО2 + СО2 + Н2О
5.Напишите уравнение реакции Si + NaOH+ H2O =
и посчитайте коэффициенты в левой части уравнения
а) 3
б) 4
в) 5
г) 6
6. Напишите уравнение реакции FeS04+H202+H2S04 =
и подсчитайте сумму коэффициентов в правой части уравнения:
а) 3
б) 4
в) 5
г) 6
7. Какова электронная конфигурация атома калия в основном состоянии:
а)...3s23p63d'
б) ...3s23p64s'
8. Какое вещество образуется при горении натрия на воздухе:
а) Na2О
б) Na3N
в) Na2О2
г) NaOz
9. В чём растворяется Ве(ОН)2:
а) Н2О
б) NaOH
в) НС1
г) (NH4)2C03
10. В виде каких соединений встречаются щелочные металлы в природе?
а) Na2O
б) NaCl*KCl
в) K2SO4
г) NaNO3
Эталоны ответов
| А Г | А | ||
| Б В | Б | ||
| А | В | ||
| А В | БВ | ||
| Б | Б Г |
Примеры заданий для рубежного контроля
Примеры заданий в тестовой форме
Задание: Укажите один или несколько вариантов правильных ответов.
1. В виде каких соединений встречается в природе фосфор:
а) Са3(Р04)2
б) Са3Р2
в) Р205
г) РС15
2. Какие из перечисленных веществ растворяют белый фосфор или реагируют с ним:
а) Н20
б) CS2
в) НС1К0нц.
г) КОН кон.гор.
3. Какие вещества получаются в результате взаимодействия олова с разбавленной (3-5%) HN03:
а) Sn(N03)2
б) Sn02*nH20
в) NH4N03
г) N02
4. Напишите уравнение реакции KMn04+NO+H2S04=HN03+... и
подсчитайте сумму коэффициентов в левой части уравнения:
а) 21
б) 24
в) 25
г) 29
5. Какого состава образуется осадок при сливании растворов СаС12, NH3, Na2HP04
а) Ca(NH4)P04
б) Са3(Р04)2
в) СаНР04
6. Напишите уравнение реакции Рбел +AgN03+H20 =Ag+... и
подсчитайтесумму коэффициентов в левой части уравнения:
а) 6
б) 8
в) 10
г) 12
7.Какая из кислот является самым сильным окислителем:
а) Н3Р03
б) Н3Р04
в) HN02
г) HN03
8. В результате каких реакций образуется пирофосфорная кислота:
а) Р205+Н20
 в) Н3Р04 t
в) Н3Р04 t
б) Na2H2P207+H20
г) РОС13+Н20
 9.Напишите уравнение реакции Н3Р04 t и подсчитайте сумму
9.Напишите уравнение реакции Н3Р04 t и подсчитайте сумму
коэффициентов в правой части уравнения:
а) 4
б) 6
в) 7
г) 9
10. Какие вещества образуются при действии света на HN03 конц.:
а) NO
б) N20
в) N02
г) 02
Эталоны ответов
| Вопрос | ответ |
| 1. | А |
| 2. | БВ |
| 3. | АВ |
| 4. | В; 6KMn04+10NO+9H2S04=10HN03+ 6 MnSO4 + 3K2SO4 + 4H2O |
| 5. | Б |
| 6. | В; Рбел +5AgN03+4H20 =5Ag+ 5HNO3 + H3PO4 |
| 7. | Г |
| 8. | АВ |
| 9. |  А; 4Н3Р04 t 3H3PO4 + PH3 А; 4Н3Р04 t 3H3PO4 + PH3
|
| 10. | ВГ |
Примеры задач для рубежного контроля
Задача 1. В пробирку с раствором дихромата калия добавили концентрированный раствор соляной кислоты. Что произошло? Объясните. Напишите уравнения химических реакций.
Решение:
К раствору дихромата калия добавили концентрированную соляную кислоту, выделился газ Cl2, и раствор из оранжевого стал сине-зеленого цвета от образовавшегося хлорида хрома (III)
K2Cr2O7 + 14HCl = 2CrCl3 + 3 Cl2 + 2 KCl + 7 H2O
 Cr+6 +3e = Cr+3 4
Cr+6 +3e = Cr+3 4
2Cl -2e = Cl20 3
Дихроматы – окислители. Концентрированная соляная кислота проявляет свойства кислоты и восстановителя.
Задача 2. В пробирку внесли 3-5 капель раствора КМn04 и 2-3 капли H2S04, затем добавили 10% раствор Н202. Что наблюдаете? Напишите уравнение реакции.
Решение:
При прибавлении небольшого количества щелочи выпадет осадок гидроксида олова(II), затем он растворится в избытке щелочи:
 SnCl2 + 2KOH= Sn(OH)2 + KCl
SnCl2 + 2KOH= Sn(OH)2 + KCl
 Sn(OH)2 + 2KOH(р-р) = K2[Sn(OH)4]
Sn(OH)2 + 2KOH(р-р) = K2[Sn(OH)4]

SnCl2 + 4KOH= 2KCl+ K2[Sn(OH)4]
Гидроксид олова (II) – амфотерное соединение.
Примеры заданий для итогового контроля
Примеры заданий в тестовой форме для I этапа
Задание: Укажите один или несколько вариантов правильных ответов.
1. Какие вещества образуются при действии света на HN03 конц.:
а) NO
б) N20
в) N02
г) 02
2.Молекула какого галогеноводорода термически наименее устойчива:
а) HF
б) НС1
в) HBr
г) HJ
3. В результате какой реакции может получиться свободный йод:
а) НJO3р-р + F2
б) HJ03р-р + С12
в) НJO3р-р + Вг2
г) НJO3р-р + KJ
4. К какому типу относится химическая связь в соединениях галогенов
с водородом:
а) ковалентная неполярная
б) ионная
в) ковалентная полярная
5. Какие вещества образуются при взаимодействии избытка хлорной воды с бромидом калия:
а) Вг2
б) НСЮ
в) КВг03
г) НС1
6. Какая кислота является наименее устойчивой:
а) HJO
б) НJОз
в) Н5JO6
7. Напишите уравнение реакции KJтв + H2S04конц= KHS04 +... и подсчитайте сумму коэффициентов в левой части уравнения:
а) 11
б) 13
в) 16
г) 17
8. Какова конфигурация валентных электронов в атоме йода в основном состоянии:
а) ...5s25p5
б) ...5s!5p35d3
в) ...5s25p35d2
9. В результате какой реакции может получиться свободный бром:
а) HBiO3 + F2
б) НВIO3,р.р + С12
в) HBr03p-p + J2
10. Молекула какого галогеноводорода наиболее полярна:
а) HF
б) НС1
в) НВг
г) HJ
Эталоны ответов
| Вопросы | Ответы |
| 1. | ВГ |
| 2. | Г |
| 3. | Г |
| 4. | В |
| 5. | ВГ |
| 6. | А |
| 7. | Г; 8KJтв + 9H2S04конц= KHS04 + 4I2 + H2S + 4H2O |
| 8. | А |
| 9. | Б |
| 10. | А |
Примеры расчетных задач на II этапе
Задача 1. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4 . 7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение.
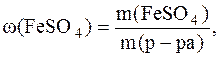
Определяем m (р-ра):
m(р-ра)=m(FeSO4.7H2O)+m(H2O)=41,7+258,3=300г.
Определяем массу FeSO4:
m(FeSO4)=n(FeSO4).M(FeSO4),
а поскольку n(FeSO4)=n(FeSO4.7H2O), то
m(FeSO4)=n(FeSO4.7H2O).M(FeSO4)=
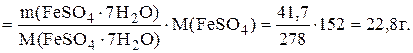
Вычисляем ω(FeSO4):
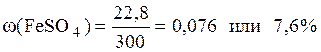
Ответ: ω(FeSO4)=0,076 или 7,6%.
Задача 2. Рассчитать молярную концентрацию в растворе HCl с массовой долей 25% (ρ=1,15г/мл).
Решение.
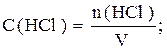
поэтому молярная концентрация равна:
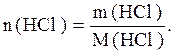
Величина m(HCl)=V·ρ·ω(HCl)=1000·1,15·0,25=287,5г;
Если объем раствора не задан, то удобно принимать его равным 1л.
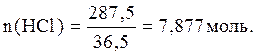
Отсюда, 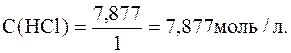
Ответ: С(НСl)=7,877моль/л.
Задача 3. Для осаждения ионов железа (II), содержащихся в 20мл раствора FeSO4, израсходовано 30мл раствора КОН (С(КОН)=0,3моль/л). Определить молярную и молярную концентрацию эквивалента сульфата железа (II).
Решение.
Фактор эквивалентности FeSO4=1/2.
По закону эквивалентов:
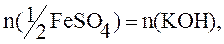
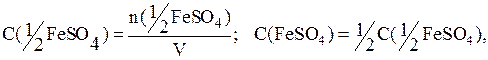
n(KOH)=C(KOH)·V=0,3·0,03=0,009моль.
Рассчитываем
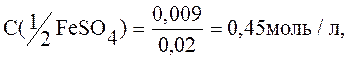
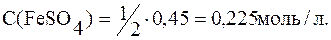
Ответ: С(1/2FeSO4)=0,45моль/л, С(FeSO4)=0,225моль/л.
Задача 4. Написать уравнение гидролиза соли, образованной слабой кислотой и сильным основанием (Na2CO3).
Решение:
1. Гидролиз – процесс обратимый.
2. Процесс ступенчатый (обычно пишут число ступеней гидролиза на одну ступень меньше, чем это возможно).

 Na2CO3+Н2О↔NaHCO3+NaOH – молекулярное уравнение.
Na2CO3+Н2О↔NaHCO3+NaOH – молекулярное уравнение.
NaOH H2CO3
Na2CO3 ↔ 2Na+ + CO3-2
CO3-2 + Н2О ↔ HCO3- + OH- - среда щелочная.
Задача 5. Написать уравнение реакции нитрита натрия NaNO2 c перманганатом калия KMnO4 в кислой среде, если конечные продукты Mn2+ и NO3-.
Решение.
1) Пишем общую схему ионного уравнения реакции:
NO2-+MnO4-+Н+→NO3-+Mn2++H2O
2) Пишем полууравнения редокс-процесса.
Ионы MnO4- принимают электроны в кислой среде и восстанавливаются в Mn2+:
MnO4-+8Н++5е→Mn2++4H2O (ред-процесс)
Ионы NO2- отдают электроны:
NO2-+H2O–2е→NO3-+2H+ (окс-процесс) и окисляются в NO3-.
3) Уравниваем коэффициенты, сокращаем подобные члены и складываем два полууравнения реакции:
MnO4-+8Н++5е→Mn2++4H2O 2
NO2-+H2O–2е→NO3-+2H+ 5
2MnO4-+16Н++10е→2Mn2++8H2O
5NO2-+5H2O–10е→5NO3-+10H+
 |
2MnO4-+5NO2-+6Н+→2Mn2++3H2O+5NO3-
В молекулярном виде это уравнение напишем так:
2KMnO4+5NaNO2+3H2SO4→2MnSO4+К2SO4+5NaNO3+3H2O
Примеры ситуационных задач на III этапе
Задача 1. В трёх пробирках находятся металлы Al, Zn, Au. В них добавили по 4-5 капель концентрированной азотной кислоты. В какой из пробирок находится алюминий? Напишите уравнения химических реакций.
Решение:
В пробирке, где находится Zn, выделяется газ NO2 бурого цвета. В других пробирках - без изменения. Оставшиеся пробирки нагревают, в пробирке с Al выделяется газ NO2
 Al + 6HNO3(конц) Al(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц) Al(NO3)3 + 3NO2 + 3H2O
 Al0 – 3e Al+3 1
Al0 – 3e Al+3 1
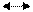 N+5 +1e N+4 3
N+5 +1e N+4 3
В пробирке с золотом никаких изменений.
Задача 2. В раствор соли нитрата висмута добавлена вода, появился осадок, затем в раствор с осадком добавили раствор азотной кислоты. Что произошло? Объясните. Напишите уравнения химических реакций.
Решение:
Нитрат висмута в водном растворе гидролизируется с образованием основных солей, среда раствора кислая
 1ст. Bi(NO3)3 + H2O BiOH(NO3)2 + HNO3
1ст. Bi(NO3)3 + H2O BiOH(NO3)2 + HNO3
 Bi3+ +3NO3- + H2O BiOH2+ + H+ + NO3-
Bi3+ +3NO3- + H2O BiOH2+ + H+ + NO3-
 Bi3++ H2O BiOH2+ + H+
Bi3++ H2O BiOH2+ + H+
 2cт BiOH(NO3)2 + H2O Bi(OH)2NO3 + HNO3
2cт BiOH(NO3)2 + H2O Bi(OH)2NO3 + HNO3
 BiOH2++ H2O Bi(OH)2+ + H+
BiOH2++ H2O Bi(OH)2+ + H+
При добавлении азотной кислоты равновесие смещается влево, в сторону образования Bi(NO3)3, те уменьшения гидролиза, т.к гидролиз - обратимая реакция. На систему, находящуюся в равновесии, подействовать каким-либо воздействием, то система противодействует данному действию(принцип Ле-Шателье)
Самостоятельная работа
(Темы для самостоятельного изучения)
Тема 1. Введение в практикум. Основные понятия и законы химии. Правила работы в химической лаборатории
Место химии в системе естественных наук и фармацевтического образования. Значение химии для развития медицины и фармации.
Номенклатура основных классов неорганических веществ.
Темы 2 - 3. Периодический закон Д.И. Менделеева и строение атома
Спектры атомов как источник информации об их строении. Периодический закон как пример действия законов материалистической диалектики – перехода количества в качество и единства и борьбы противоположностей.
Темы 4 – 6. Химическая связь, строение молекул
Характерные структуры трех, четырех, пяти и шестиатомных молекул.
Химическое строение и электронные спектры поглощения молекул (УФ, видимая и ближняя ИК – области). Изучение строения радикалов методом электронного парамагнитного резонанса (ЭПР). Изучение распределения электронной плотности в молекулах с помощью ядерного магнитного резонанса (ЯМР); представление о химическом сдвиге ЯМР сигнала.
Темы 7 - 8. Комплексные соединения
Комплексные кислоты, основания, соли. Пикомплексы. Карбонилы металлов. Биологическая роль КС. Металлоферменты, понятие о строении их активных центров. Химические основы применения в фармации и медицине.
Темы 9 - 10. Растворы. Концентрация растворов
Решение расчетных задач по теме.
Тема 11. Закон эквивалентов
Решение расчетных задач по теме.
Темы 12 - 13. Растворимость. Гидролиз солей
Решение ситуационных задач на гидролиз.
Темы 14 – 15. Ионные равновесия в растворах электролитов
Роль ионных, в том числе кислотно-основных взаимодействий при метаболизме лекарств, в анализе лекарственных препаратов, при приготовлении лекарственных смесей. Химическая несовместимость лекарственных веществ.
Решение ситуационных задач на гидролиз.
Темы 16 - 18. Окислительно-восстановительные (ОВ) реакции, закономерности их протекания
Роль окислительно-восстановительных процессов в метаболизме.
Решение ситуационных задач по ОВР.
Тема 19. Итоговое занятие
II семестр
Тема 20. s-элементы. Химические свойства водорода и его соединений
Дистиллированная и апирогенная вода, их получение и применение в фармации. Природные воды, минеральные воды.
Тема 21. s-элементы. Металлы I и II группы
Биологическая роль s-элементов металлов в минеральном балансе организма. Макро- и микро- s-элементы. Макро- и микро –s- элементы. Поступление в организм с водой. Жесткость воды, единицы её измерения, пределы, влияние на живые организмы и протекание реакций в водных растворах, методы устранения жесткости. Соединения кальция в костной ткани, сходство ионов кальция и стронция, изоморфное замещение (проблема стронция – 90).
Ядовитость беррилия. Химические основы применения соединений лития, натрия, калия, магния, кальция, бария в медицине и в фармации.
Биологическая роль и применение в медицине производных элементов этих соединений.
Тема 22. d – элементы I группы
Комплексный характер медьсодержащих ферментов и химизм их действия в метаболических реакциях. Природа окраски соединений меди. Химические основы применения соединений d-элементов I группы в медицине и фармации.
Тема 23. d – элементы II группы
Комплексная природа цинкосодержащих ферментов и химизм их действия. Химические основы применения в медицине и фармации соединений цинка. Кадмий и его соединения в сравнении с аналогичными соединениями цинка.
Химизм токсического действия соединений кадмия и ртути. Химические основы применения соединений ртути в медицине и фармации.
Тема 24. d – элементы VI группы
Молибден и вольфрам, общая характеристика, способность к образованию изо-поли и гетеро-поликислот; сравнительная окислительно-восстановительная характеристика соединений молибдена и вольфрама по отношению к соединениям хрома.
Биологическое значение d-элементов VI группы. Химические основы применения соединений хрома, молибдена и вольфрама в фармации (фармацевтическом анализе).
Тема 25. d - Элементы VII
Химические основы применения калия перманганата и его раствора как антисептического средства и в фармацевтическом анализе.
Тема 26. d-элементы VIII группы
Кобальт и никель. Химическая активность простых веществ по сравнению с железом. Соединения кобальта (II) и (III), никеля (II), КО и ОВ характеристики, способность к комплексообразованию (реакция Чугаева). Никель и кобальт как микроэлементы (кофермент В12). Химические основы применения соединений кобальта и никеля в медицине и фармации.
Общая характеристика элементов семейства платины.
Тема 27. p-элементы III группы
Биологическая роль бора. Антисептические свойства борной кислоты и её солей.
Квасцы. Физико-химические основы применения алюминия в медицине и фармации.
Темы 28 - 29. p-элементы IV
Элементы подгруппы германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа ЭГ2 и ЭГ4, поведение в водных растворах. Оловохлористоводородная кислота. Оксиды. Оксид свинца (IV) как сильный окислитель. Амфотерность гидроксидов. Растворимые и нерастворимые соли олова и свинца. ОВ реакции в растворах. Химизм токсического действия соединений свинца. Применение в медицине свинецсодержащих препаратов (свинца (II) ацетат, свинца (II) оксид). Химические основы использования соединений олова и свинца в анализе фармпрепаратов.
Темы 30 - 31. p-элементы V группы
Элементы подгруппы мышьяка. Общая характеристика. Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша.
Соединения мышьяка, сурьмы и висмута с положительными степенями окисления. Галиды и изменение их свойств в группе (азот-висмут). Оксиды и гидроксиды Э (III) и Э (V), их КО и ОВ характеристики. Арсениты и арсенаты, КО и ОВ свойства. Соли катионов сурьмы (III) и висмута(III), их гидролиз. Сурьмяная кислота и её соли. Висмутаты. Неустойчивость соединений висмута (V).
Понятие о химических основах, применение в медицине и в фармации аммиака, оксида азота (I) (закиси азота), нитрата и нитрита натрия, оксидов и солей мышьяка, сурьмы и висмута. Химические основы использования соединений р-элементов V а группы в фармацевтическом анализе.
Темы 32 - 33. p-элементы VI группы
Биологическая роль серы (сульфгидрильные группы и дисульфидные мостики в белках). Химические основы применения серы и её соединений в медицине, фармации, фармацевтическом анализе.
Селен и теллур. Общая характеристика. КО и ОВ свойства водородных соединений и их солей. Оксиды и кислоты, их КО и ОВ свойства (в сравнении с подобными соединениями серы). Биологическая роль селена.
Темы 34 - 35. p-элементы VII
Понятие о химизме бактерицидного действия хлора и йода. Применение в медицине, санитарии и фармации хлорной извести, хлорной воды, препаратов активного хлора, йода, а также соляной кислоты, фторидов, хлоридов, бромидов и иодитов.
Элементы группы VIIIa (благородные газы). Общая характеристика. Физические и химические свойства благородных газов. Соединения благородных газов. Применение благородных газов в медицине.
Тема 36 – 38. Итоговое занятие. Подготовка студентов к экзамену.
СПИСОК ТЕМ ДЛЯ РЕФЕРАТОВ
1. Загрязнение атмосферного воздуха. Кислотные дожди. Разрушение озонового слоя.
2. Эндемические заболевания.
3. Соединения водорода, кислорода, углерода, серы, азота и фосфора в живых организмах, их биологическая роль и применение в медицине.
4. Соединения натрия, калия, магния, кальция, железа, кобальта, марганца, молибдена, цинка и меди в живых организмах, их биологическая роль и применение в медицине.
КРИТЕРИИ ОЦЕНОК РЕФЕРАТОВ
Оценка «ОТЛИЧНО» выставляется за правильное и полное раскрытие темы реферата. При написании реферата необходимо использовать рекомендованную и дополнительную литературу.
Оценка «ХОРОШО» выставляется при недостаточном раскрытии темы реферата и использовании только рекомендованной литературы.
Оценка «УДОВЛЕТВОРИТЕЛЬНО» выставляется за неполное, неточное раскрытие темы реферата и использование только Интернет-ресурсов.
Оценка «НЕУДОВЛЕТВОРИТЕЛЬНО» выставляется при невыполнении реферата.
Учебно-методические указания для самостоятельной работы студентов имеются на кафедре.
VI. Учебно-методическое и информационное обеспечение дисциплины
а). Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 350 c.
б). Дополнительная литература:
1. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 340 с.
2. Конспект лекций по общей химии [Текст]: учебно-методическое пособие для студентов 1 курса (1 семестр) / Твер. гос. мед. акад.; под ред. Г.М. Зубаревой. – Тверь: Типография “Печатница”, 2010 г. – 60 с.
3. Химия элементов и их соединений. [Текст]: Элективный курс лекций для студентов I курса фармацевтического факультета. / Твер. гос. мед. акад.; под ред. Г.М. Зубаревой. – Тверь: Типография “Печатница”, 2010 г. – 60 с.
4. Общая химии. Учебно-методическое пособие [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета/ Лопина Н.П., Бордина Г.Е., Халяпина Я.М. // Под общей редакцией: доктора биологических наук, профессора Г.М. Зубаревой. – Тверь: Ред.-издат. центр Твер. гос. мед. акад., 2012. – 100 с.
5. Неорганическая химии. Учебно-методическое пособие [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета/ Лопина Н.П., Бордина Г.Е., Халяпина Я.М. // Под общей редакцией: доктора биологических наук, профессора Г.М. Зубаревой. – Тверь: Ред.-издат. центр Твер. гос. мед. акад., 2012. – 74 с.
5. Тетрадь для лабораторных работ по общей химии для очного фармацевтического факультета. [Текст] / Твер. гос. мед. акад.; под ред. Г.М. Зубаревой. – Тверь: Типография “Печатница”, 2010 г. – 250 с.
в). Программное обеспечение и Интернет-ресурсы:
www.studmedlib.ru – электронная библиотека медицинского вуза
www.chem.msu.ru/rus/library - библиотека химического факультета МГУ
VII. Материально-техническое обеспечение дисциплины
Для обеспечения учебного процесса кафедра имеет:
1. Лабораторное оборудование:
1. Мерные колбы.
2. Мерные цилиндры.
3. Конические колбы.
4. Пипетки.
5. Бюретки.
6. Термометры.
7. Спиртовки.
8. Пробирки.
9. Весы.
2. Кинофильмы.
1. Растворы высокомолекулярных соединений.
2. Уникальные свойства воды.
3. Технические средства обучения.
1. Мультимедийный проектор
VIII. Научно-исследовательская работа студента
Научно-исследовательская работа студентов организована в рамках работы кружка СНО на кафедре химии. Практикуется реферативная работа и проведение научных исследований с последующим выступлением на итоговых научных студенческих конференциях в Твери и в других городах России, а так же публикацией в сборниках студенческих работ, кафедральных сборниках .
IX. Протоколы согласования рабочей программы дисциплины (модуля) с другими дисциплинами: физическая и коллоидная химия, аналитическая химия, органическая химия.
| <== предыдущая страница | | | следующая страница ==> |
| ПО ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ | | | РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ. Направление(я) подготовки 030300 - Психология Профиль(и) подготовки бакалавра Бакалавр психологии Кафедра-разработчик |
Дата добавления: 2014-10-17; просмотров: 405; Нарушение авторских прав

Мы поможем в написании ваших работ!