
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Адсорбция
Различают два вида адсорбции – химическую и физическую. Они различаются по своей природе.
Причиной физической адсорбции является взаимодействие Ван-дер-Ваальса, химадсорбции– образование химических связей. Рассмотрим это последовательно.
Физическая адсорбция. Взаимодействие Ван-дер-Ваальса заключается в том, что сближение атомов абсорбата с поверхностью вызывает поляризацию и того, и другого, и в результате этого, появляются силы притяжения.
Простейшая модель: имеются два диполя, один из которых соответствует атомам на поверхности, а другой – атомам абсорбата. Наша задача – показать, что такое положение энергетически выгодно. Это можно показать законами классической термодинамики.
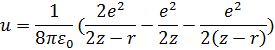
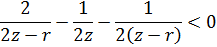
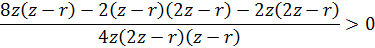
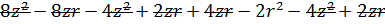
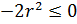
Итого:
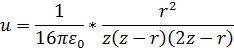

Это сильно упрощенная модель, более правильная оценка дается следующим образом:
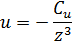
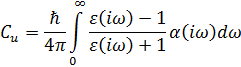
Экспериментально эта картина может быть проверена следующим экспериментом: запустить кучу атомов возле края твердого тела, и когда расстояние становятся маленькими, пучок атомов начинает отклоняться под действием сил Ван-дер-Ваальса. Соответственно, отклонение становится заметным на расстоянии в сотни ангстрем, т.е. в сотни атомных расстояний. В частности, для рассеяния на золоте щелочных металлов была получена Cu~ 4эВ*А3.
По угловому значению константы можно определить, когда силы Ван-дер-Ваальса будут удерживать атомы. Адсорбат должен находиться на поверхности абсорбента на расстоянии, сравнимым с атомными расстояниями.
18.10.14
Вторым типом является …, т.е. образование химических связей. Равновесие твердого абсорбента и жидкого/газообразного адсорбата приводит к определенной вероятности образования химических связей.
Образование идет по однослойному механизму, т.е. образуется центр, и от него идет рост адсорбата.
Математически это можно описать уравнением адсорбции Гиббса:
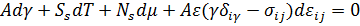
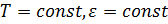
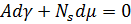
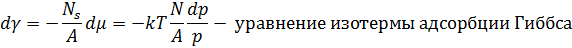
Уравнение приводит к выводу: чистая поверхность термодинамически не стабильна, поскольку с ростом числа адсорбированных атомов поверхностное натяжение убывает. Практические значения типичных адсорбентов, например, Ns(O2) ~ 1014 см-2, т.е. равновесная концентрация получается порядка одного нанослоя.
Для того, чтобы устанавливать математические зависимости, необходимо установить связь температуры, давления, и числа адсорбированных частиц.
Исходя из статистических соображений, можно указать следующее:
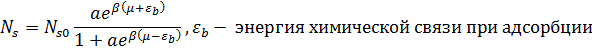

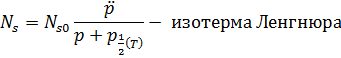
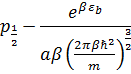
Данное уравнение можно подставить в уравнение для поверхностного натяжения и получить следующее (после интегрирования ура-я Ленгнюра):
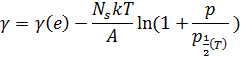
Производя измерения поверхностного натяжения при разных температурах, мы можем найти множество зависимостей и константы, и тем самым вычислим энергию образца, поверхностную энергию атома, и т.д.
Типичные энергии адсорбции составили εb = 0,5…4 эВ. Энергии связи достаточно большие, и сравнимы с энергией связи в органических веществах. Энергия связи в водороде составляет 9,6 эВ.
Экспериментальным материалом для построения независимости является следующая зависимость:
типичный ход зависимости заключается в том, что с ростом температуры способность к адсорбции уменьшается, поскольку возрастает вероятность отскока адсорбируемого атома от действия теплового движения. Что характерно для таких измерений: достаточно иметь метод измерения поверхностного натяжения для вакуумного оборудования, и возможность работы его при низких давлениях, для того, чтобы адсорбция не происходила слишком близко.
В связи с тем, что энергия связи при адсорбции является характеристическим параметром, т.е. соответствует паре с адсорбатом/абсорбентом, возникла идея использовать это для описания этого взаимодействия. Возник экспериментальный метод термодисорбции.
Идея достаточно простая – нужно нагревать образец, на котором находится некоторое количество адсорбентов, и рассмотреть, в зависимости от температуры, насколько интенсивно будет адсорбат с него испаряться. Физически (качественно) – каждый вид хим. связей будет разрываться только с определенной температуры, когда энергия теплового вырождения станет достаточно большой, чтобы энергетическое состояние было энергетически выгодным.
Различают две методики эксперимента:
1. Термодисорбция
2. Импульсная дисорбция.
Основным способом измерить число атомов, дисорбированных с пов-ти, является испарение в камере прибора. Исходя из того, как измерять давление, и делится на два типа эксперимента. В силу того, что энергии достаточно высокие, следовательно, требуются высокие температуры, самые высокие, которые могут быть в камерах (несколько тысяч градусов, вольфрам/молибден).
Возникает зависимость (2) от температуры, которая и характеризует концентрацию адсорбата в определенных энергетических состояниях. Чем сильнее повышается температура, тем сильнее расплываются пики, т.к. система откачки не успевает выкачать.
Исходя из этих соображений, приобретает всё большую популярность импульсная десорбция. В этом случае не только не пытаются избежать, но и рассчитывают на то, что часть частиц не выкачается. Измеряется зависимость давления от времени нагрева, при этом, в каждый момент времени считается, что откачаться не успело вообще ничего, и концентрация пропорциональна интегралу по температуре:
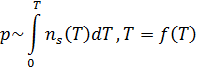
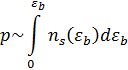
Давление может быть вплоть до атмосферного.
Рассмотрим математически
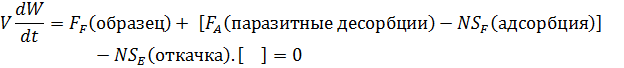
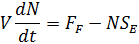
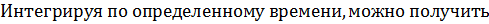
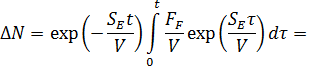
Для термодесорбции мы ждем обнуления этой величины, чтобы перейти к следующей температуре.
Интегрируя, получим
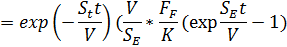
Учитывая, что откачки нет, тогда экспоненту можно исключить, и считать, что число частиц будет определяться интегралом:
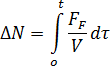
Скорость десорбции частиц, деленная на скорость (???)
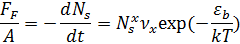
Ns – концентрация частиц на поверхности
x – количество частиц, участвующих в одном акте десорбции (порядок реакции)
νx – константа, зависящая от рода вещества.
В интеграл подставляем предыдущую формулу, которая сама по себе зависит от времени. Из-за этого, в зависимости от порядка реакции, ход будет в зависимости от времени отличаться принципиальным образом. Это позволяет определять и порядок реакции.
Порядок реакции первый – ур-е дает насыщающуюся экспоненту
Порядок реакции второй – зависимость получится гиперболического вида.
Реакция первого порядка начинается раньше, но идет медленней, чем реакция второго порядка.
Экспериментальное оборудование.
Прежде всего нужна система откачки до глубокого вакуума, средства измерения давления и нагрева до высоких температур, и средства для того, чтобы различать частицы между собой.
Поскольку вакуумные системы дорогие, …
| <== предыдущая страница | | | следующая страница ==> |
| Анизотропия поверхностного натяжения | | | РАСЧЕТ ЧИСЛЕННОСТИ ПРОИЗВОДСТВЕННОГО ПЕРСОНАЛА |
Дата добавления: 2014-11-14; просмотров: 306; Нарушение авторских прав

Мы поможем в написании ваших работ!