
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Методы определения активности аминотрансфераз сыворотки крови
2. Практическое занятие для клинических интернов
3. Значение темы (актуальность изучаемой проблемы).
Широкое использование определения активности ферментов в клинических лабораториях всего мира представляет собой одно из наиболее важных достижений современной медицины.
Около 20% публикаций в одном из наиболее авторитетных журналов - «Clinical Chemistry» посвящены вопросам клинической энзимологии, еще 20% публикаций - использованию ферментов в качестве аналитических реактивов
Сегодня в большинстве лабораторий более двух третей так называемых рутинных аналитов определяют с использованием ферментов.
4. Цели обучения:
Разобрать клинико-диагностическое значение определения индикаторных ферментов в сыворотке крови и моче, принципы и этапы определения; возможные ошибки пре- и аналитического этапов, пути их исправления.
На основе теоретических знаний и практических умений обучающийся должен знать и уметь:
- подготовить тест-систему к работе
- уметь пользоваться автоматическими пипетками
- уметь работать на фотометре (ФЭК, с проточной термостатируемой кюветой)
- определить уровень АСТ, АЛТ в сыворотке крови методом по конечной точке
- определить уровень АСТ, АЛТ в сыворотке крови кинетическим методом
- знать определение активности ЛДГ, КК в сыворотке крови
4. План проведения занятия:
1. Определение исходного уровня знаний (устный опрос по теме занятия, тесты)
2. Самостоятельная работа:
- определить уровень АСТ, АЛТ в сыворотке крови методом по конечной точке
- определить уровень АСТ, АЛТ в сыворотке крови кинетическим методом
3. Контроль проведенной работы
4. Итоговый тестовый контроль знаний
5. Подведение итогов занятия
4.1. Самостоятельная работа по теме:
1. Определение активности аминотрансферазы методом по конечной точке (см. Учебно-методическое пособие:Каталог наборов реагентов для клинической биохимии «Vital diagnostics» , стр. 2, 6)
2. Определение аминотрансферазы кинетическим методом (см. Учебно-методическое пособие:Каталог наборов реагентов для клинической биохимии «Vital diagnostics» , стр. 4,8)
4.2. Исходный контроль уровня знаний.
4.2.1. Вопросы для самоподготовки.
Ø Какие ферменты относятся к индикаторным ферментам, их специфичность, представители.
Ø Характеристика локализации в тканях АСТ, АЛТ.
Ø Клиническое значение определения АТ в ЛПУ разного уровня.
Ø Референтные величины нормального уровня АТ в крови , возрастные особенности
Ø Факторы повышающие (понижающие) уровень АТ. Эффект разведения.
Ø Клиническое значение определения ЛДГ и ее фракций в ЛПУ разного уровня.
Ø
Ø Референтные величины уровня ЛДГ и ее изоферментов в крови , возрастные особенности
Ø Преаналитический этап (особенности подготовки больного, получения, хранения биоматериала для исследования активности ферментов)
Ø Ошибки аналитического этапа при определении АТ
Ø Влияние лекарственных препаратов на активность индикаторных ферментов
Методы с фиксированным временем инкубации
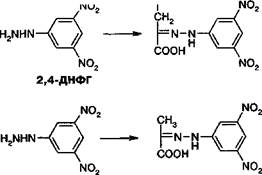
Основаны на способности кетокислот вступать в реакцию с 2,4-динитрофенилгидразином (2,4-ДНФГ) и образовывать гидразоны кетокислот
Ограничения фотометрического метода определения АсАТ и АлАТ связаны с несколькими факторами.
1. При определении активности аминотрансфераз в среде инкубации могут находиться одновременно по две кетокислоты (при определении АсАТ — а-кетоглютаровая и ЩУК, АлАТ — а-кетоглютаровая и ПВК. Обе кетокислоты легко вступают в реакцию с 2,4-ДНФГ и образуют динитрофенилгидразоны. В начале реакции, катализируемой АсАТ, в инкубационной среде содержится только а-кетоглютаровая кислота, определяющая величину поглощения в контрольной пробе. В ходе реакции ее концентрация снижается, а содержание ЩУК возрастает. В ходе реакции, катализируемой АлАТ, в среде инкубации происходит накопление ПВК и уменьшение содержания а-кетоглютаровой кислоты.
СООН
 СООН
СООН
СН2
СООН ЩУК
| + н„о |
СН3
С = О СООН ПВК
Образование 2,4-динирофенилгидразонов щавелевоуксусной и пировиноградной кислоты
2. Некоторые кетокислоты сыворотки, в частности, ПВК, ацетоуксусная кислоты, ацетон способны к образованию фенилгидразонов. При увеличении их содержания в крови они вызывают увеличение поглощения инкубационной среды.
3. Максимумы поглощения фенилгидразонов щавелевоуксусной, пировиноградной и а-кетоглютаровой кислоты достаточно близки, но отличаются.
4. Основным недостатком метода является невозможность определения активности фермента в широком диапазоне активности из-за ингибирования фермента АсАТ продуктом реакции — ЩУК, накапливающейся в среде инкубации при исследовании образцов с высокой активностью. Показано, что ЩУК способна ингибировать оба изофермента АсАТ, митохондриальный изофермент ингибируется в большей степени. При высокой активности АлАТ концентрация субстрата может быстро снижаться, что приводит к отклонению от кинетики нулевого порядка.
Точностные характеристики метода не удовлетворяют требованиям, изложенным в приказе МЗ РФ № 45 от 07.02.2000 г., в связи с чем необходимо переходить к методам, основанным на непрерывной регистрации (кинетическим).
Определение активности аминотрансфераз в сыворотке крови с использованием 2,4 динитрофенилгидразина
Об активности ферментов судят по приросту ЩУК и ПВК, образующих с 2,4-динитрофенилгидразином (2,4-ДНФГ) гидразоны соответствующих кетокислот при рН 7,1-7,3 , которые приобретают окраску в щелочной среде.
Комментарии:
1. Образование гидразонов кетокислот проходит в слабоосновной среде, а максимумом поглощения гидразоны обладают в щелочной среде, в связи с чем концентрацию соляной кислоты и гидроксида натрия следует четко контролировать. Время образования
гидразонов кетокислот не должно быть менее 20 мин.
2. Присутствие больших количеств карбоната натрия в растворе может искажать результаты, поэтому рабочий раствор гидроксида натрия (0.4 моль/л) следует готовить из концентрированных растворов гидроксида натрия с концентрацией 400—500 г/л, «вы
стоявшихся» в течение 1—2 недель. Концентрацию рабочего раствора следует проверять с помощью приемов объемного анализа. Приготовленный раствор следует хранить в плотно закупоренной посуде.
3. Калибровочный график для определения активности аминотрансфераз строят с использованием дистиллированной воды вместо раствора субстрата. При корректном построении графика и использовании фотометров типа ФЭК-56, КФК-2, КФК-2МП прямая зависимость между концентрацией ПВК в пробе и поглощением сохраняется до 0.25 мкмоль. При концентрации ПВК в пробе выше 0.25 мкмоль наблюдается отклонение от прямой пропорциональной зависимости. При использовании приборов с узкополосными светофильтрами (КФК-3) или спектрофотометров (СФ-46) прямая пропорциональная зависимость соблюдается до концентрации ПВК в пробе 0.3 мкмоль.
4. В крови больных сахарным диабетом могут в избыточном количестве накапливаться кетокислоты и ацетон, способные образовывать соответствующие гидразоны в реакции с 2,4-ДНФГ и ложно завышать результаты определения, если фотометрия будет проводиться не против собственного контроля на реактивы, включающего исследуемый материал.
5. Время реакции при определении АлАТ должно составлять 30 минут, при определении АсАТ — 1 час. Удлинение времени инкубации АлАТ до 1 часа способно привести к завышению результатовпри сравнении с результатами, полученными при 30 минутной инкубации.
6. В основе феномена «эффекта разведения» лежат особенности самого метода, где концентрация кетокислоты является недостаточной для определения высокой активности фермента, однако ее концентрация в среде инкубации не может быть повышена, так как это приведет к увеличению значений контрольной пробы, на фоне которой трудно зафиксировать образование гидразонов ПВК и ЩУК.
Методы непрерывной регистрации (kinetic)
Контроль за скоростью реакции переаминирования осуществляют сочетанием аминотрансферазной реакции с реакцией, катализируемой соответствующей субстрату дегидрогеназой. Кетокислоты, образующиеся в аминотрансферазной реакции, определяют путем ферментативного превращения в соответствующие гидроксикислоты по изменению концентрации НАДН2 в среде инкубации. Например, ЩУК превращается в яблочную кислоту в присутствии малатдегидрогеназы (МДГ) (рис.), а ПВК превращается в молочную кислоту при участии ЛДГ — непрямой оптический тест Варбурга.
Субстраты, кофермент НАДН2 и вспомогательные ферменты МДГ и ЛДГ добавляют в среду инкубации в избытке, чтобы скорость реакции зависела только от активности АсАТ или АлАТ.
| Аспарагиновая кислота |
| Яблочная кислота |
| НАД |
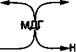
 а-кетоглютаровая кислота
а-кетоглютаровая кислота
| НАД Н2 |
Глютаминовая кислота
| Дегидрогеназная реакция Определение кетокислоты Индикаторная реакция |
Аминотрансферазная реакция
Образование кетокислоты
Основная реакция
Рис. Сочетание основной и ндикаторной реакции при определении активности АсАТ и АлАТ методом непрерывной регистрации
При определении активности аминотрансфераз кинетическим методом требуется фотометр, позволяющий проводить измерения при длине волны 340 нм. Температуру инкубационной среды в кювете необходимо поддерживать на постоянном уровне. Запуск реакции проводят после окончания восстановления при участии НАДН2 эндогенных кетокислот, попадающих в инкубационную среду вместе с исследуемым образцом. После окончания лаг-фазы реакцию запускают добавлением субстрата — а-кетоглютаровой кислоты и контролируют изменение поглощения АА/мин. В связи с тем, что величина поглощения инкубационной среды в начале реакции колеблется в пределах 1.3—1.5, для установки исходного поглощения реакционной смеси в пределах 0.7-0.9 в качестве контрольной пробы (blank) используют раствор бихромата калия.
Для определения активности АсАТ было предложено сочетание иных ферментативных реакций, в частности, использование в качестве индикаторного фермента глютаматдегидрогеназы (ГлДГ) и НАД качестве кофермента (рис.). Для расчета активности АсАТ используется скорость образования НАДН2, т. е. увеличение экстинкции, а не уменьшение, как в предыдущей реакции.
В настоящее время активность АсАТ и АлАТ в сыворотке в подавляющем большинстве зарубежных лабораторий определяют кинетическими методами. Наиболее популярные в настоящее время методы определения АлАТ приведены в таблице 20. Методы различаются по некоторым параметрам: концентрации субстрата, типу буферного
| Аспарагиновая кислота |
| НАДН2 |

|
а-КГ
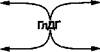
|
| НАД |
| ЩУК |
Глютамат
Рис.. Сочетание реакций при определении активности АсАТ при использовании ГлДГ в качестве индикаторного фермента
| Сравнительная характеристика методов определения активности АлАТ | ||||
| Компоненты инкубационной среды | ААСС" | IFCC11 | Scandinavian" | DGKC" |
| Конечная концентрация реактивов (ммоль/л) | ||||
| L-апанин | ||||
| а-кетоглютаровая кислота | ||||
| рН буферного раствора | 7.3 | 7.5 | 7.4 | 7.4 |
| ТРИС | - | |||
| Фосфатный | - | - | - | |
| НАДН2 | 0.16 | 0.18 | 0.15 | 0.18 |
| П-5'-Ф | 0.1 | 0.1 | - | - |
| ЛДГ(Е/л) | 1.2 | 1.2 | 2.0 | 1.2 |
| ЭДТУК | - | - | 0.5 | - |
| Соотношение сыворотка/среда | 0.082 | 0.083 | 0.12 | 0.135 |
| Температура | 30 °С | 30 °С | 37 °С | 37 °С |
1)ААСС — Американская ассоциация клинической химии, 2)IFCC — Международная федерация клинической химии, 3)SSCC — Скандинавское общество клинической химии и клинической физиологии, 4) DGKC — Немецкое общество клинической химии
раствора (ТРИС или фосфатный ) и температуре реакции. При выборе условий реакции авторы стремились подобрать оптимальные соотношения между компонентами инкубационной среды, определяющими скорость реакции. Определение аминотрансферазной активности образца рекомендуют проводить в присутствии кофермента аминотрансфераз П-5'-Ф. Несмотря на различия, используемая концентрация субстрата обеспечивает скорость реакции в пределах 96 % от теоретических значений Vmax.
5.2. . ПРЕАНАЛИТИЧЕСКИЙ ЭТАП ИССЛЕДОВАНИЯ АКТИВНОСТИ ФЕРМЕНТОВ
АЛАНИНАМИНОТРАНСФЕРАЗА (АлАТ)
Материал для исследования.Свежая негемолизированная сыворотка или плазма. Свежая капиллярная или венозная кровь, кровь, взятая с гепарином (для выполнения исследований на тест-полосках и анализаторе.
.Время взятия и доставки в лабораторию. При плановых исследованиях с 7 до 9 ч утра. При экстренных анализах — в любое время дня.
Подготовка пациента. Исключить прием алкоголя, физические нагрузки, прием лекарств, интерферирующих при определении активности АлАТ. Натощак, при взятии крови пациент находится в положении лежа или сидя.
Методика взятия. Кровь берется в химически чистую центрифужную пробирку или в коммерческую одноразовую пробирку под вакуумом. Для получения плазмы в качестве антикоагулянтов могут быть использованы гепарин и его соли (натрия или лития). Для определения активности АлАТ в лабораторию доставляют по возможности быстрее 1 мл крови или 0,5 мл сыворотки. На 1 определение в зависимости от метода требуется 0,02—0,1 мл сыворотки или плазмы.
Условия доставки и хранения. Свежая капиллярная или венозная кровь используются для анализа в течение 2—3 мин. Гепаринизированная кровь — в течение 1 ч, взятая в гепаринизированный капилляр — в течение 15 мин.
Исследование активности фермента в сыворотке или плазме должно быть произведено в день взятия биожидкости, поскольку активность АлАТ быстро снижается при хранении.
Рекомендуемые сроки хранения: в закрытой пробирке при комнатной температуре 3 дня, при 2—8°С — 7 дней и при замораживании при -20°С — не более 2 дней. Повторное оттаивание и замораживание недопустимы.
Примечания. С возрастом активность АлАТ имеет тенденцию к снижению. У женщин более низкие величины активности, чем у мужчин. При приеме алкоголя активность повышается, при прерывании запоя —снижается. Отчетливы сезонные изменения активности, так, пик ее наблюдается весной и падение — осенью. В течение дня наибольшая активность — в утренние часы с падением в послеобеденные часы. В плазме активность АлАТ статистически, но не клинически достоверно ниже, чем в сыворотке
Внутрииндивидуальная вариация 23,0%,
межиндивидуальная —41,1%.
Повышают активность АлАТ: курение, голодание, физические нагрузки, алкоголизм, травмы, отсутствие физической активности, литотрипсия, мышечный массаж, прием сахарозы.
Гемолиз вызывает значительное завышение результатов вследствие более
высокой активности фермента в эритроцитах, чем в сыворотке. Липемия может оказывать двоякое влияние: вызывать занижение результатов вследствие рассеяния света с 340 нм к 380 нм или завышение результатов. Истощение витамина В6 более снижает активность АлАТ, чем АсАТ. Лекарства, вызывающие гепатотоксический эффект и холестаз, вызывают повышение активности АлАТ.
Аналитическое снижениевызывают дофамин, метилдопа (в методах на тест-полосках),дипирон, ибупрофен, рифампин, кетопрофен, метотрексат
(в колориметрических методах); увеличение — ацетаминофен (в колориметрических методах), аминофеназон, аминосалициловая кислота, хлордиазэпоксид
АСПАРТАТАМИНОТРАНСФЕРАЗА (АсАТ)
Материал для исследования. Свежая капиллярная или венозная кровь без антикоагулянта или с антикоагулянтом гепарином и его солями натрия или лития (для экспресс-определения на анализаторе Свежая негемолизированная сыворотка или плазма крови.
Время взятия. При плановых исследованиях — 7—9 ч утра, при экспресс-анализах — любое время дня.
Подготовка пациента. Кровь берется натощак, пациент находится в положении лежа или сидя. Физические нагрузки и прием алкоголя исключены.
Методика взятия. См. АлАТ, Методика взятия. При получении сыворотки или плазмы после центрифугирования крови их необходимо как можно быстрее отделить от сгустка и клеток.
Условия доставки и хранения. Свежая капиллярная или венозная кровь используется для анализа в течение 2—3 мин, гепаринизированная кровь — в течение 15 мин. АсАТ в сыворотке стабильна при комнатной температуре в течение 1 дня в капилляре с гепарином — 15 мин, закрытой пробирке — 8 ч. Хранение сыворотки или плазмы при комнатной температуре в закрытом сосуде может быть увеличено до 4 дней при 2—8°С, при -20°С, по данным разных авторов, — от 3 мес (Сиаег У\/. и
соавт., 1996) до, по меньшей мере, 1 года (цит. Н. Тиц, ред., 1997) и даже неопределенно долго. При -70°С АсАТ стабильна до 5 лет .
Примечания. С возрастом активность АсАТ снижается. У женщин всех возрастов активность несколько меньше, чем у мужчин. В течение беременности происходит увеличение активности АсАТ. Физические нагрузки, курение, голодание, ожирение, прием пищи, алкоголя, сахарозы, травмы, операции, ожоги, алкоголизм, прерывание запоев, внутримышечные инъекции вызывают повышение активности АсАТ. Более высокая активность наблюдается в январе и марте по сравнению с авгу-
стом. В течение дня больших колебаний активности АсАТ не наблюдается.
Внутрииндивидуальная вариация 11,6%,
межиндивидуальная —13,6%.
Оттаивание замороженной сыворотки или плазмы с последующим замораживанием ведет к снижению активности АсАТ. В плазме активность АсАТ статистически достоверно более высокая, чем в сыворотке (гепарин).
Билирубинемия (в реакциях конечной точки с диазониевыми солями), гемоглобин и гемолиз (вслед-
ствие высокой активности АсАТ в эритроцитах и тромбоцитах), липемия, хранение цельной крови, ацетоацетат, кетоз (интерференция с диазониевыми солями) вызывают ложнозавышенныерезультаты.
Остатки жидкого мыла на лабораторной посуде, оксалацетат ингибируют активность АсАТ. Гепарин вызывает ложное завышение результатов в методе "сухой химии" на слайдах Лекарства, обладающие гепатотоксическим действием, и соли железа, вызывающие холестаз, увеличивают активность АсАТ, алкалоиды опия, аскорбиновая кислота, формальдегид, цианиды, фталат, тартрат, глютарат, истощение витамина Вб занижают результаты
Аналитическое занижение активности АсАТ вызывают: ацетоаминофен (при высоких концентрациях), аминофеназон, аскорбиновая кислота (в методе на тест-полосках анализатора), кло-
тианин, рифампин, пиндолол; завышение — ацетоаминофен (терапевтические дозы), аспирин (диазониевые методы), аскорбиновая кислота, хлордиазэпоксид, диклофенак, эритромицин, гентамицин, гидралазин, изониазид, изопротеренол, леводопа, метилдопа, нитрофурантоин, фенелзин,пиридоксаль, сульфатиазол, толбутамид.
| Референтные интервалы для АсАТ и АлАТ, сыворотка, плазма (гепарин, ЭДТА, цитрат, оксапат) | ||||
| Сыворотка, плазма ( МЕ/л ) | АсАТ | АлАТ | ||
| Методы рекомендованные IFCC- и DGKC 37 °С | ||||
| Взрослые | мужчины | 10-35 | 10-35 | |
| женщины | 10-50 | 10-50 | ||
| Дети | 1-3 года | 10-50 | 1-30 дней | 1-25 |
| 4-6 лет | 10-45 | 2-1 2 месяцев | 4-35 | |
| 7-9 лет | 10-40 | 1-3 года | 5-30 | |
| 10-1 2 лет | 10-40 | 4-6 лет | 5-25 | |
| 13-1 5 лет | 10-35 | 7-9 лет | 5-25 | |
| 16-1 8 лет | 10-35 | 10-1 8 лет | 5-30 |
| <== предыдущая страница | | | следующая страница ==> |
| | | Иностранная интервенция в мировой истории (XIX – XX вв.) |
Дата добавления: 2014-11-20; просмотров: 1340; Нарушение авторских прав

Мы поможем в написании ваших работ!