
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ПЕРИОДИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
1 РАДИУС АТОМА И АТОМНЫЙ ОБЪЕМ
С точки зрения квантовой механики атом не имеет строго определенных границ, поэтому установить его абсолютные размеры невозможно.
Эффективные радиусы («проявляющие в действии») – рассчитаны из экспериментальных данных по межъядерным расстояниям в молекулах и кристаллах. На размер таких радиусов влияет структура вещества, характер связи, степень окисления,etc.
Различают эффективные радиусы:
ü ковалентный радиус – равен половине межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ.
ü металлический радиус – равен половине межъядерного расстояния между центрами двух соседних атомов в кристаллической решетке металла.
ü ионный радиус – рассчитывается для кристаллов с преимущественно ионной связью.
Выделяют ионный радиус для катиона ( 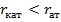 ) и аниона (
) и аниона ( 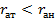 )
)
PS Орбитальный радиус – теоретически рассчитанное расстояние до главного максимума электронной плотности внешней орбитали. Радиус внешней орбитали атома или иона определяет атомный или ионный радиус.
Орбитальный радиус – характеристика свободного атома или иона, т.е. не зависит от природы химической связи.
2 ИОНИЗАЦИЯ
Энергия ионизации, Eион – минимальная энергия, необходимая для отрыва наиболее слабо связанного электрона от невозбужденного атома: Х +Eион→ Х+ + е-
Потенциал ионизации, I – наименьшее напряжение электрического поля, при котором происходит отрыв электрона.
Единицы измерения: [Eион]=1 кДж/моль [I]=1эВ/атом (электрон-вольт на атом)
Численное значение I равно Eион выраженной в эВ
1 эВ – энергия, которую приобретает частица, обладающая элементарным электрическим зарядом, проходя разность потенциалов в 1В.
1 эВ=1,602·10-19 Дж
Для конкретного атома: I1< I2< I3…
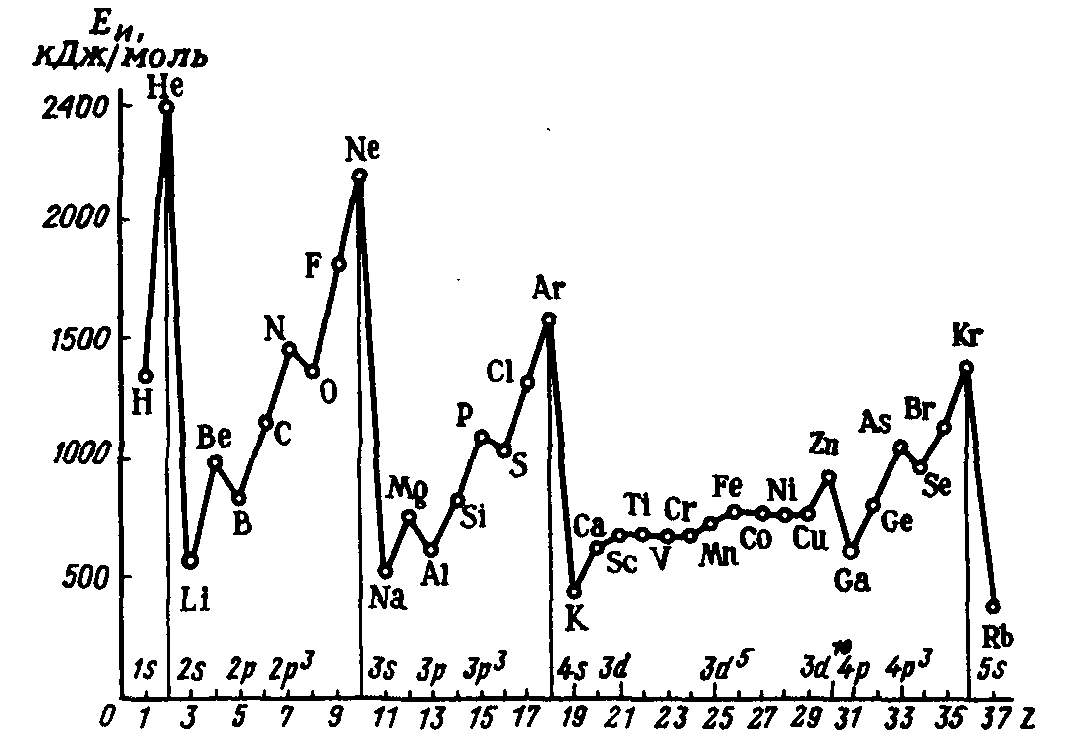
Энергия ионизации всегда имеет эндоэнергетическое значение
Зависимость Eион от атомного номера
| <== предыдущая страница | | | следующая страница ==> |
| | | СРОДСТВО К ЭЛЕКТРОНУ |
Дата добавления: 2014-11-24; просмотров: 252; Нарушение авторских прав

Мы поможем в написании ваших работ!