
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ
силы межмолекулярного взаимодействия с энергией
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
Ориентационные силы (диполь-дипольное притяжение)
Осуществляется между молекулами, являющимися постоянными диполями.
В результате беспорядочного теплового движения молекул при их сближении друг с другом диполи в веществе ориентируются с выигрышем энергии. Чем более полярны молекулы, тем сильнее они притягиваются и тем сильнее ориентационное взаимодействие.
Такое взаимодействие характерно для полярных молекул (NH3, H2O и др.). Повышение температуры ослабляет это взаимодействие, так как тепловое движение нарушает взаимную ориентацию молекул.
Энергия взаимодействия: E 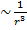 (в молекулярных кристаллах) и E
(в молекулярных кристаллах) и E 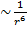 (для жидкостей газов).
(для жидкостей газов).
Дисперсионное притяжение (лондоновские силы)
Взаимодействием между мгновенным и наведенным диполем.
Каждый атом является диполем в любой момент времени, так как электрон и ядро являются противоположно заряженными частицами (мгновенный диполь). Если имеется несколько атомов поблизости, то их диполи ориентируются в пространстве («+» к «−») с выигрышем энергии. Такое взаимодействие характерно для любых атомов и молекул. Оно тем больше, чем более тяжелыми являются частицы (больше зарядов − больше взаимодействий). Дисперсионное взаимодействие наиболее универсальное, т. е. проявляется в любых случаях.
Энергия взаимодействия: E 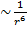
Индукционное притяжение
Взаимодействие между постоянным диполем и наведенным (индуцированным).
Между полярной и неполярной молекулой и обусловлено тем, что дипольные молекулы индуцируют в соседних молекулах диполи. Индуцированные диполи взаимодействуют между собой и другими диполями, что дает выигрыш в энергии. Энергия этого взаимодействия тем больше, чем больше поляризуемость молекул.
EG в H2S это взаимодействие больше, чем в Н2О, так как поляризуемость S2− больше, чем O2−.
Энергия взаимодействия: E 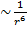
Суммарная энергия межмолекулярного взаимодействия составляет обычно около 10 кДж/моль. Наименьший вклад обычно вносит индукционное взаимодействие. В случае атомов (He, Ar и др.) и неполярных молекул (H2, N2, etc) наибольший вклад дает дисперсионное взаимодействие.
Все три вида взаимодействия возрастают с ростом молекулярной массы.
По сравнению с ковалентной связью ван-дер-ваальсовое взаимодействие очень слабое. Так, если энергия, необходимая для диссоциации молекулы Cl2 на атомы, составляет 243 кДж/моль, то энергия сублимации (возгонки) кристаллов Cl2 составляет всего 25 кДж/моль.
| <== предыдущая страница | | | следующая страница ==> |
| ИОННАЯ СВЯЗЬ | | | АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВ |
Дата добавления: 2014-11-24; просмотров: 315; Нарушение авторских прав

Мы поможем в написании ваших работ!