
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ИОННАЯ СВЯЗЬ
электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов. Предельный случай полярной ковалентной связи. Разность ЭО (по Полингу) >2.
Ионная связь между атомами в чистом виде реализуется очень редко, обычно связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Модель свободных электронов: в этой модели металл представляется как совокупность катионов, образующих остов, как бы погруженных в электронную жидкость, частицы которой (электроны) свободно перемещаются между катионами. Энергия связи определяется как кулоновское взаимодействие между катионами и электронами.
Эта теория хорошо описывает свойства щелочных металлов. В частности, структура металлов определяется тем, что минимум энергии системы достигается при плотнейшей упаковке катионов, что имеет место при координационных числах 8 и 12; при этом связь оказывается ненаправленной, так как изменения в геометрии расположения атомов и даже изменения координационного числа в указанных пределах мало изменяют энергию связей. Эта модель, однако, плохо объясняет свойства других металлов и спектры металлов.
ВОДОРОДНАЯ СВЯЗЬ
форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты. Последние могут иметь линейное, разветвленное или кольцевое строение. Ассоциация приводит к повышению 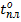 ,
, 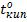 и теплоты парообразования, изменению растворяющей способности,etc.
и теплоты парообразования, изменению растворяющей способности,etc.
Энергия водородной связи меньше ковалентной и ионной (менее 40 кДж/моль). Она тем больше, чем больше электроотрицательность элемента.
EG
| связь | энергия, кДж/моль |
| Н...F | |
| Н...О | |
| Н...N |


| <== предыдущая страница | | | следующая страница ==> |
| ГЕОМЕТРИЯ МОЛЕКУЛ | | | ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ |
Дата добавления: 2014-11-24; просмотров: 225; Нарушение авторских прав

Мы поможем в написании ваших работ!