
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ГЕОМЕТРИЯ МОЛЕКУЛ
ТЕОРИЯ ГИБРИДИЗАЦИИ
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
NB! Гибридизация не является реальным физическим процессов, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи.
Модель не является строго количественной, так она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода.
ТЕОРИЯ ОТТАЛКИВАНИЯ ЭЛЕКТРОННЫХ ПАР ВАЛЕНТНЫХ ОРБИТАЛЕЙ (ОЭПВО)
Электронные пары валентной оболочки атома (в молекуле) взаимно отталкиваются и располагаются вокруг атома таким образом (под такими углами), чтобы это отталкивание было минимальным.
Формула Гиллеспи:
АХnEm, где А − центральный атом,
X – связывающие электронные пары,
E – несвязывающие электронные пары,
n и m – число соотвествующих пар.
В формуле учитываются только те электронные пары, которые находятся в σ- положении к атому А, т.е. их электронные плотности направлены по оси связи с атомами В; все Е-пары также находятся в σ-положении.
В методе ОЭПВО с учётом гибридизации принимают, что все электронные пары занимают примерно одинаковое пространство. Для простоты считают, что они представляют собой сферы одинакового радиуса. Если размеры всех электронных пар вокруг атома А одинаковы, то они образуют правильные фигуры.
Основные положения метода ОЭПВО:
1. несвязывающие электронные пары отталкивают сильнее, чем связывающие, поэтому они искажают форму молекулы;
2. несвязывающие электронные пары располагаются на максимальном удалении друг от друга;
3. чем больше ЭО концевых атомов (В), тем сильнее они отталкиваются несвязывающей электронной парой;
4. кратные связи отталкивают сильнее, чем ординарные (одинарные);
5. искажение углов между связями под действием неподеленной электронной пары тем больше, чем больше число свободных АО на валентной оболочке атома и большее ее размеры;
6. для тригонально-бипирамидальных молекул аксиальные атомы В ближе к атому А, чем экваториальные;
7. для пентагонально-бипирамидальных – аквсиальные связи короче экваториальных.
Последовательность действий:
1) определить общее число электронных пар атома А;
2) по этому числу (n+m) − форму правильной фигуры, образуемой электронными облаками;
3) установить, сколько связывающих, несвязывающих и кратных пар;
4) определить геометрию молекулы.
EG молекула тетрафторида ксенона XeF4
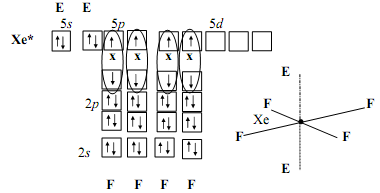
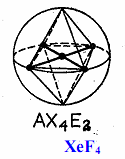
Таблица 1 – Описание геометрии молекул в методах гибридизации и ОЭПВО (Гиллеспи)
| Тип гибридизации | ОЭПВО (n+m) | Геометрия | EG | Тип гибридизации | ОЭПВО (n+m) | Геометрия | EG |
| sp | Линейная
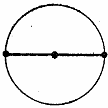
| BeCl2 | dsp2 | Квадрат | [ICl4]- | ||
| sp2 | Треугольная
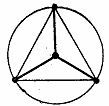
| BCl3 | sp3d | Тригональная
бипирамида
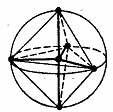
| PCl5 | ||
| sp3 | Тетраэдр
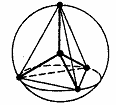
| CH4 | sp3d2 d2sp3 | Октаэдр
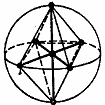
| SF6 |
Вопросы:
1. Изобразите пространственное строение следующих молекул: XeOF4, SOCl2, ClBr3, IF7.
2. Три изомера дихлорэтиленов имеют дипольные моменты: 0; 1,7 и 2,5 D. Каково строение каждого из них?
3. Значения дипольного момента для молекул аммиака, фосфина и арсина равны соответственно - 1,46; 0,55; 0,15 D. Объясните закономерность.
4. Укажите молекулы, для которых значение дипольного момента одинаково: N2, COS, NH3, CS2, CCl4, XeOF4, C2H2, Ar, H2O, H2SO4, SF6, SO2.
5. При расчетах получено значение дипольного момента для дихлорэтана равное 2,4 D, однако, эмпирические данные оказались значительно ниже (1,2 - 1,8 D). Объясните данное явление.
ЗАДАЧИ
Задача 1
Значения энергий связи в молекулах хлора и водорода соответственно равны: 243 и 436 кДж/моль.
a) рассчитайте количество энергии, которая выделится при превращении в однозарядные анионы всех молекул хлора массой 71 мкг (потенциал сродства к электрону для атомарного хлора равен 3,61 эВ/атом);
b) рассчитайте количество энергии необходимое для превращения в однозарядные катионы всех молекул водорода массой 44 мкг (значение потенциала ионизации атомарного водорода равно 13,60 эВ/атом);
c) вычислите, в каком массовом соотношении следует взять водород и хлор для того чтобы количество энергии выделившееся в процессе (a) полностью израсходовалось на процесс (b). Рассчитайте, как изменится соотношение при условии, что 15 % энергии рассеивается.
Задача 2
Для определения структуры молекул в газовой фазе широко используют спектроскопический метод, который позволяет найти межъядерное расстояние по спектрам молекул. По спектроскопическим данным были рассчитаны межъядерные расстояния в молекуле BI3: r(B-I) = 210 пм, r(I-I) = 364 пм.
a) определите, какую геометрическую фигуру образуют ядра атомов в этой молекуле;
b) какой тип гибридизации центрального атома позволяет описать строение данной молекулы.
Задача 3
Величину эффективного заряда δ можно рассчитать по формуле:
δ=i·ω, где i – степень ионности, ω – степень окисления элемента;
i=1-exp[-0.25(χA- χB)2], где χ – значение электроотрицательности элемента.
a) вычислите значение дипольного момента (D) для молекулы хлороводорода, если длина связи равна 127 пм, а значения электроотрицательностей равны: χ(H)=2,10; χ(Cl)=2,83.
Задача 4
Для расчета дипольного момента молекул, содержащих более двух жестко закрепленных групп, применяется метод проекций, согласно которому дипольный момент молекулы равен: 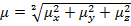 , где
, где 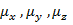 - алгебраическая сумма проекций на ось x, y, z соответственно.
- алгебраическая сумма проекций на ось x, y, z соответственно.
Для простоты расчетов начало координат помещают в центр молекулы, например, дипольный момент диоксида углерода можно рассчитать, используя только две оси - x, y:
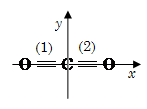
В данном случае сумма проекций моментов на оси равна:
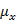 = μ(СО)(2) - μ(СО)(1)=0;
= μ(СО)(2) - μ(СО)(1)=0;
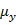 = 0.
= 0.
Таким образом: μ(CO2)=0 D.
a) вычислите величину дипольного момента молекулы формальдегида, принимая, что валентные углы не искажаются. Дипольные моменты связей равны: μ(С=О)=2,70 D, μ(С-H)=0,40 D;
При расчете дипольных моментов многоатомных молекул используют вместо дипольных моментов связей результирующий групповой момент, что позволяет использовать исключить введение в расчеты в явном виде моменты некоторых связей, например, C-H.
Так, групповой момент метильной группы равен 0,37 D (для производных бензола). И таким образом дипольный момент п-ксилола можно рассчитать при помощи метода проекций:
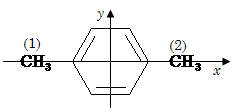
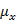 = μ(СH3)(2) - μ(СH3)(1)=0;
= μ(СH3)(2) - μ(СH3)(1)=0;
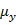 = 0.
= 0.
 Таким образом: μ(п-ксилол)=0 D.
Таким образом: μ(п-ксилол)=0 D.
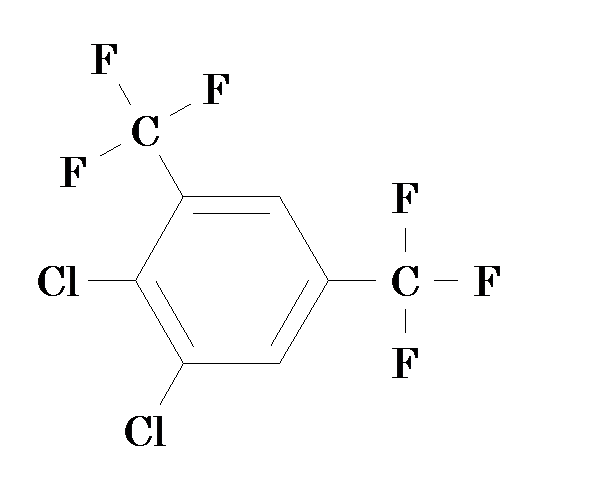
b) рассчитайте дипольный момент 4,5-дихлор-1,3-бис-трифторметил-бензола. Принимая, что валентные углы не искажаются, а групповые моменты равны: μ(CF3)=2,54 D; μ(Cl)=1,59 D.
| <== предыдущая страница | | | следующая страница ==> |
| НЕКОТОРЫЕ АСПЕКТЫ ХИМИЧЕСКОЙ СВЯЗИ | | | ИОННАЯ СВЯЗЬ |
Дата добавления: 2014-11-24; просмотров: 1042; Нарушение авторских прав

Мы поможем в написании ваших работ!