
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
НЕКОТОРЫЕ АСПЕКТЫ ХИМИЧЕСКОЙ СВЯЗИ
ХИМИЧЕСКАЯ СВЯЗЬ
электростатическое взаимодействие двух атомов, осуществляемое путем обмена электронами.
КОВАЛЕНТНАЯ СВЯЗЬ (атомная связь, гомеополярная связь)
химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характеристики:
1 полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
Дипольный момент ( 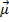 ) – векторная величина:
) – векторная величина:
ü дипольный момент связи
μ=l·q, где l – длина диполя, м;
q=δ·е , где е – элементарный электрический заряд, Кл;
δ – частичный заряд, изменяется от 0 до 1
Вектор 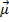 направлен от положительного заряда к отрицательному.
направлен от положительного заряда к отрицательному.
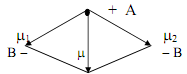
ü дипольный момент молекулы
геометрическая сумма дипольных моментов связей
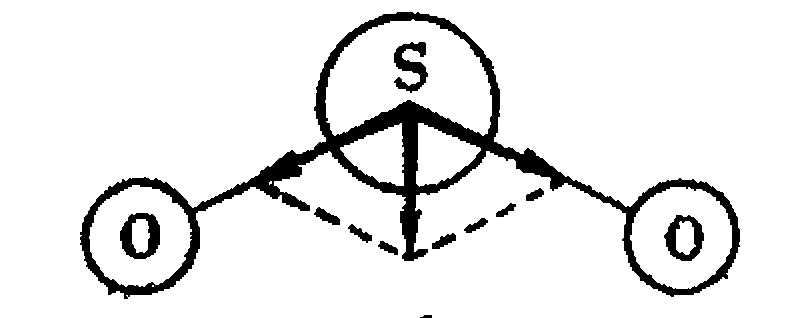
Рисунок 1 – Дипольный момент молекулы SO2
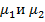 - дипольные моменты связи,
- дипольные моменты связи,
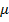 - дипольный момент молекулы
- дипольный момент молекулы
Единицы измерения: дебай (D): 1D = 3,33·10-30 Кл·м
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
2 энергия связи – энергия, необходимая для того, чтобы разорвать связь и удалить образовавшиеся фрагменты молекулы на бесконечно большое расстояние.
3 насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
4 длина связи – расстояние между ядрами атомов, образующих связь.
5 валентный угол – угол между линиями, соединяющими химически связанные атомы.
| <== предыдущая страница | | | следующая страница ==> |
| СРОДСТВО К ЭЛЕКТРОНУ | | | ГЕОМЕТРИЯ МОЛЕКУЛ |
Дата добавления: 2014-11-24; просмотров: 213; Нарушение авторских прав

Мы поможем в написании ваших работ!