
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Дробный метод анализа минерализата
В химико-токсикологическом анализе для обнаружения ионов металлов в минерализатах используется дробный метод анализа, основоположником которого является Н. А. Тананаев. Большой вклад в разработку метода и внедрение его в практику судебно-химических лабораторий внесла А. Н. Крылова. Метод основан на применении реакций, с помощью которых в любой последовательности можно обнаружить ионы в отдельных небольших порциях исследуемого раствора. Для обнаружения соответствующих ионов дробным методом необходимо применять специфические реактивы, позволяющие обнаружить искомый ион в присутствии посторонних ионов. В качестве реакций идентификации избраны наиболее чувствительные и специфичные. Предпочтение отдано жидкофазным реакциям, что позволяет исключить процессы фильтрования, промывания, упаривания и приводит не только к ускорению процесса анализа, но и к повышению его чувствительности. Доказательность и надежность метода достигается применением основной (специфичной) и дополнительной (подтверждающей) реакций.
Обнаружение искомых ионов дробным методом производится в два этапа. Вначале устраняют влияние мешающих ионов с помощью соответствующих реактивов или их смесей, а затем прибавляют реактив, дающий окраску или осадок с искомым ионом.
Дробный метод анализа особенно удобен в тех случаях, когда задача эксперта-токсиколога ограничена заданием провести исследование только на определенные ионы или исключить тот или иной ион. Таким образом, дробный метод анализа подходит для решения практических задач судебно-химической экспертизы.
Специфические особенности судебно-химического анализа на «металлические» яды заключаются в следующем:
1. Необходимость выделения из большого количества биологического объекта малых количеств (мг, мкг) веществ, которые могли послужить причиной отравления.
2. Необходимость исследования на сравнительно большую группу ядов (13 элементов), обладающих некоторой общностью химических свойств.
3. Специфический характер объектов исследования. Ими чаще всего являются внутренние органы трупа, которые могут содержать в качестве естественных почти все химические элементы, известные как «металлические» яды (за исключением Ba, Bi, Sb, TI). Поэтому всегда встаёт вопрос о количественном определении. Данные количественного анализа позволяют судебно-медицинским экспертам решать вопрос, являются ли найденные металлы, введенными в организм или естественно содержащимися в организме.
Учитывая специфические особенности судебно-химического анализа, А.Н.Крылова при разработке дробного метода предъявила к нему ряд требований, обеспечивающих быстроту, надёжность и экономичность исследований:
1. Возможность сочетания качественного и количественного определения в одной навеске исследуемого органа на все токсикологически важные элементы (за исключением ртути, которая определяется в отдельной навеске деструктивным методом).
2. Высокая доказательность и надёжность метода. Это достигается применением для каждого катиона, как правило, не одной, а, по меньшей мере, двух реакций: основной и подтверждающей.
3. Высокая специфичность реакций, чтобы определять искомый катион в присутствии других. Однако абсолютно специфичных реакций очень мало, поэтому создаются селективные условия, и устраняется мешающее влияние других ионов, для чего разработаны специальные приёмы.
4. Высокая чувствительность реакций, но в то же время, они не должны открывать естественно содержащиеся количества элементов.
5. Простота, доступность методик обнаружения «металлических» ядов. Их проведение не должно требовать больших затрат времени на анализ и дорогостоящего оборудования и реагентов.
При составлении схемы проведения дробного анализа необходимо учитывать ограниченную специфичность отдельных реакций:
1. Чувствительность реакций на хром и марганец снижается при большом количестве в минерализате хлорид ионов, поэтому исследование на хром и марганец рекомендуется проводить до осаждения Ag в виде AgCl с помощью NaCl.
2. Обнаружению мышьяка мешает присутствие в минерализате катионов сурьмы, в связи с чем, исследование на сурьму предшествует анализу на мышьяк.
3. Большие количества меди мешают обнаружению сурьмы по реакции обнаружения ее сульфида Sb2S3 (черный осадок CuS маскирует оранжевую окраску Sb2S3). Следовательно, в ряду катионов по схеме дробного анализа медь должна стоять раньше сурьмы.
Для повышения надежности обнаружения «металлических» ядов А.Н. Крылова предложила определенный порядок их обнаружения в минерализате, а именно: свинец, барий, марганец, хром, серебро, медь, сурьма, таллий, мышьяк, висмут, кадмий, цинк. Параллельно проводится анализ на ртуть после деструкции отдельной навески биологического материала.
Для устранения влияния мешающих катионов используют приемы маскировки. Маскировкой называется процесс устранения влияния одних ионов, находящихся в сложной смеси, на обнаружение других ионов и является одной из важнейших операций в дробном анализе. При маскировке мешающие ионы переводят в соединения или такие ионы, которые теряют способность вступать во взаимодействие с реактивами на искомый ион. Существует несколько способов маскировки катионов.
I. Комплексообразование
Комплексообразование — это использование такого реактива, который с мешающими катионами образует бесцветные прочные комплексные ионы, не способные реагировать с реактивами на искомые ионы.
С этой целью применяют:
1) фториды для маскировки ионов железа (III), в виде прочного бесцветного комплексного иона [FeF6]3-;
2) фосфаты для маскировки ионов железа (III), [Fe(PO4)2]3--;
3) тиосульфаты для маскировки ионов серебра, свинца, железа (III), меди и других катионов;
4) гидроксиламин образует комплекс с ионами кобальта
[Co(NH2 )OH)6]2+;
5) тиомочевина используется для маскировки ионов висмута, железа (III), сурьмы (III), кадмия, ртути, серебра и других катионов, образуя внутрикомплексные соединения;
6) глицерин с катионами висмута, свинца, кадмия и другими образует глицераты;
 |
7) трилон Б образует прочные внутрикомплексные соединения с ионами кадмия, кобальта, меди, железа, марганца, свинца, цинка, магния;
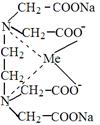 |
8) лимонная кислота и ее соли (цитраты) с катионами ряда металлов дают прочные соединения, строение которых можно выразить следующими формулами, и используется для маскировки ионов висмута, меди, железа (Ш), сурьмы (III), кадмия, ртути, серебра;
 |
9) винная кислота и ее соли (тартраты) образуют прочные комплексы с ионами меди, алюминия, висмута, кадмия, ртути, свинца, цинка, железа (III);
 |
10) цианиды применяют для устранения влияния кобальта, железа (III), железа (II), никеля, цинка, кадмия, ртути, серебра.
II. Взаимодействие катионов, содержащихся в минерализате с раствором дитизона в хлороформе при различных значениях рН среды водной фазы.
Молекула дитизона (дифенилтиокарбазона) может существовать в двух таутомерных формах в зависимости от кислотности среды реакции минерализата, и взаимодействовать с катионами, давая прочные дитизонаты с характерным окрашиванием хлороформного слоя.
 |
Например: при рН = 7,5—8,0 с ионами свинца дитизон образует комплекс оранжево-красного цвета, при рН = 4,5—5,0 с ионами цинка дитизон образует комплекс пурпурно-красного цвета, а с ионами серебра и ртути — золотисто-желтого при рН = 1,0—2,0. С некоторыми катионами дитизон образует нестойкие и быстро разлагающиеся комплексы (с железом и марганцем).
III. Изменение степени окисления ионов
Для маскировки ионов железа (III) и олова (IV) используют аскорбиновую кислоту, которая может восстанавливаться до щавелевой или дегидроаскорбиновой. Гидроксиламин может выступать и как окислитель при взаимодействии, например с ионами таллия (III) или железа (Ш) или как восстановитель при взаимодействии с арсенитами или стибитами.
Fe3+ + NH2OH + ЗОН- ® Fe2+ + NO + ЗН2О
AsO22- + NH2OH ® AsO33- + NH3
IV. Экстракция и реэкстракция катионов в виде комплексов с диэтилдитиокарбаматом
Для этой цели применяют натриевые и аммониевые соли диэтилдитиокарбаминовой кислоты (ДДТК). Эти соли хорошо растворимы в воде, их растворы бесцветны, и они взаимодействуют с катионами тяжелых металлов, образуя соли — диэтилдитиокарбаматы этих металлов, растворимые в хлороформе.

Соли имеют характерные окраски (например, ДДТК меди — бурую, кобальта и хрома (III) — зеленую).
Использование экстракции в виде комплексов с ДДТК в сочетании с комплексообразованием (использование цитратов, цианидов, комплексона (III) для связывания мешающих ионов) дает возможность выделить эти элементы из среды минерализата в органическую фазу, свободную от остальных ионов. Специфичность экстракционных методик выделения меди, висмута, цинка и кадмия достигается за счет применения правила рядов Тананаева Н.А. в ряду ДДТК металлов:
Hg2+, Ag 1+, Сu2+, Co2+, Pb 3+, Bi3+, Cd 2+Tl1+, Sb 3+, Zn2+, Mn2+, Fe 3+,
где каждый предыдущий металл в водном растворе вытесняет последующий из его ДДТК, растворенного в хлороформе.
Например
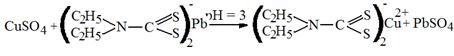 |
Диэтилдитиокарбаматы цинка, висмута, кадмия легко разлагаются под действием минеральных кислот (смотри соответствующие катионы).
V. Удаление катионов в виде осадка
Этот прием устранения влияния мешающих ионов используют при наличии в минерализате серебра, поскольку оно со многими реактивами (хлоридами, йодидами, сульфидами и др.) образует окрашенные осадки, что мешает обнаружению других катионов. В этом случае серебро удаляют из минерализата в виде нерастворимого в кислой среде осадка серебра хлорида (смотри обнаружение серебра).
| <== предыдущая страница | | | следующая страница ==> |
| Методом сухого озоления | | | Исследование осадка |
Дата добавления: 2014-12-09; просмотров: 1673; Нарушение авторских прав

Мы поможем в написании ваших работ!