
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Соединения ртути
Токсикологическое значение соединений ртути
Ртуть и ее соединения применяются в технике, химической промышленности, медицине. Оксид и другие соединения ртути применяется в медицине для приготовления мазей. В технике она используется при изготовления ламп, термометров и ряда приборов. Существуют три группы веществ, отличающиеся токсическими свойствами: а) элементарная металлическая ртуть; б) неорганические ее соединения; в) органические соединения. Наиболее часто используемыми неорганическими соединениями ртути являются оксиды ртути (I) и (II), амидохлорид ртути, хлориды ртути (I) и (II), цианид ртути (II), ацетат ртути, бромид ртути (II), сульфид ртути (II). Желтый оксид ртути (II) входит в состав глазной мази, а амидохлорид ртути — в мази для лечения кожных заболеваний. Красный оксид ртути (II) применяется для получения красок. Хлорид ртути (I) или каломель используется в пиротехнике и как фунгицид. Хлорид ртути (II) или сулема применяется в медицине как дезинфицирующее средство, в технике она используется для обработки дерева, получения некоторых видов чернил, травления и чернения стали, в сельском хозяйстве как фунгицид. Органические соединения ртути, нашли широкое применение в сельском хозяйстве как фунгициды, пестициды и средства для обработки семян (гранозан, крезан, галлотокс, аретан). Большинство этих соединений являются токсичными.
Отравления соединениями ртути — это чаще всего несчастные случаи. Явления отравления наступают немедленно. Появляются жгучие боли по ходу пищевода и в желудке, рвота белыми клочьевидными массами с примесью крови, а через некоторое время понос с кровью, в моче обнаруживается белок и часто кровь, затем моча прекращает выделяться. К этим явлениям присоединяются обмороки, иногда судороги, и при общем упадке сил наступает смерть. В острых случаях смертельный исход наблюдается через несколько часов, но иногда отравление затягивается на шесть — восемь дней. Выделение яда происходит очень медленно, через потовые и слюнные железы, вследствие чего на деснах образуется темно-серая «ртутная» кайма. В основном же соединения ртути выводятся через почки и толстый кишечник, в котором образуются язвы, как следствие действия ртути на слизистую. Почки при этом застойны, увеличены в размерах. При гистологическом исследовании в них наблюдаются тяжелые изменения.
При поступлении металлической ртути в желудок она мало токсична. Пары металлической ртути и пыль, содержащая соединения этого металла, могут поступать в организм с вдыхаемым воздухом. Ртуть в концентрации 5 мг/м3 в воздухе может вызвать острое отравление. При этом поражается центральная нервная система (в первую очередь кора головного мозга). Поступившая в организм металлическая ртуть и ее соединения, являются протоплазматическими ядами, связываются с сульфгидрильными группами ферментов и других жизненно важных белков. В результате этого нарушаются физиологические функции некоторых клеток и тканей организма. Соединения этого металла хорошо проникают через гис-тогематические барьеры. При хронических отравлениях соединениями ртути в основном поражается ЦНС. Наибольшая концентрация металла определяется в печени, почках, крови, мозге, волосах, эпидермисе. В норме содержание ртути в моче ниже 10 мкг/л, токсической является содержание 150—200 мкг/л. В органах трупа ртуть может сохраняться не только десятки, а при определенных условиях и сотни лет. Естественное содержание ртути в печени 0,001 мг и почках 0,04 мг на 100 г органа.
Исследование биологического материала на наличие ионов ртути
Изолирование ртути методом деструкции
Для деструкции берут по 20 г измельченных органов (печень, почки) и подвергают деструкции отдельно. Биоматериал вносят в коническую колбу вместимостью 200 мл, в которую прибавляют 5 мл воды, 1 мл этилового спирта и 10 мл кислоты азотной концентрированной. Затем в колбу малыми порциями прибавляют 20 мл кислоты серной концентрированной с такой скоростью, чтобы окислы азота не выделялись из колбы. После окончания прибавления кислоты серной концентрированной колбу оставляют на 5—10 мин при комнатной температуре (до прекращения выделения оксидов азота). Затем колбу устанавливают на кипящую водяную баню и нагревают в течение 10—20 мин. Если после нагревания колбы на кипящей водяной бане останутся неразрушенными кусочки биологического материала, то их осторожно растирают стеклянной палочкой о стенки колбы. При бурном протекании реакции с выделением оксидов азота в колбу прибавляют 30— 50 мл горячей воды. Полученный горячий деструктат смешивают с двойным объемом кипящей воды и, не охлаждая, фильтруют через двойной увлажненный фильтр. Фильтр и остатки жира на нем 2—3 раза промывают горячей водой. Промывные воды присоединяют к деструктату. Полученную при этом жидкость собирают в колбу, содержащую 20 мл насыщенного раствора мочевины, предназначенной для денитрации деструктата. Затем деструктат охлаждают, доводят водой до определенного объема и исследуют его на наличие ртути.
Реакция с дитизоном. Половину деструктата вносят в делительную воронку, прибавляют 10 мл хлороформа и взбалтывают в течение 1 мин. Хлороформный слой, в который могут переходить различные примеси из деструктата, отбрасывают. Взбалтывание деструктата с новыми порциями хлороформа проводят до тех пор, пока не перестанет окрашиваться хлороформный слой. После этого к очищенному от примесей деструктату прибавляют 5 мл хлороформа, 0,3 мл 0,01 % раствора дитизона в хлороформе и взбалтывают. Появление желтой или оранжево-желтой окраски хлороформного слоя указывает на наличие ионов ртути в деструктате. При взбалтывании хлороформного слоя с 0,5 М раствором кислоты хлористоводородной окраска сохраняется (в отличие от серебра дитизоната).
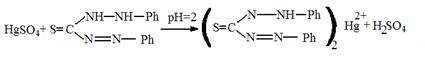 |
Реакция со взвесью меди иодида (I). К хлороформному раствору ртути дитизоната прибавляют 3 мл 0,25 % раствора йода в калия йодиде и энергично встряхивают. Реэкстракт отделяют от органической фазы, помещают в пробирку, добавляют насыщенный раствор йода до уравнивания окраски с контролем — 0,25 % раствором йода в калия йодиде. При добавлении 2 мл составного раствора (смесь меди сульфата, натрия сульфита и натрия бикарбоната в соотношении 1:2:1,5) образуется осадок, окрашиваемый в присутствии ионов ртути от розового до кирпично-красного цвета.
 |
CuSO4 + 2KI ® CuI2 + K2SO4
2CuI2 ®2Cu+I2
2CuI + K2 HgI4 ® Cu2HgI4↓ + 2KI
Натрия сульфит прибавляют для того, чтобы выделившийся йод не маскировал окраску образующегося комплекса.
I2 + Na2SO3 + H2O ® 2 HI + Na2SO4
В результате реакции образуется йодистоводородная кислота, которая смещает значение рН, поэтому ее связывают натрия гидрокарбонатом.
HI + NaHCO3 ® NaI + СО2 + Н2О
В общем виде уравнение реакции можно записать следующим образом:
K2HgI4 + 2CuSO4 + 2KI + Na2SO3 + 2NaHCO3 ®
Cu2HgI4↓+ Na2SO4 + 2K2SO4 + 2NaI + 2CO2 + H2O
| <== предыдущая страница | | | следующая страница ==> |
| Соединения кадмия | | | Методы количественного определения «металлических» ядов в минерализате |
Дата добавления: 2014-12-09; просмотров: 476; Нарушение авторских прав

Мы поможем в написании ваших работ!