
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лабораторная работа № 4
«Приготовление раствора соды заданной концентрации»
Цель работы
Основываясь на предварительных расчетах, путем разбавления водой 1%-ного раствора  приготовить 200 мл раствора соды (
приготовить 200 мл раствора соды (  ) заданной концентрации. Титрованием установить точную концентрацию полученного раствора.
) заданной концентрации. Титрованием установить точную концентрацию полученного раствора.
Теоретическая часть
Растворы представляют собой жидкие диссоционные системы, образованные частицами растворителя, растворенного вещества и тех неопределенных, но экзотермических соединений, которые между ними образуются.
Образование растворов сопровождается выделением или поглощением теплоты (теплота растворения). При этом изменяются свойства, как растворяемого вещества, так и растворителя.
Истинные растворы представляют собой гомогенные многокомпонентные дисперсные системы с размером частиц дисперсной фазы менее 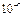 см (молекулы, ионы).
см (молекулы, ионы).
Растворитель это компонент, взятый в избытке, и агрегатное состояние которого сохраняет раствор.
Способность веществ растворяться количественно оценивают величиной растворимости. Растворимость некоторого вещества – это его концентрация в насыщенном растворе.
Коэффициент растворимости – число граммов растворенного вещества в насыщенном растворе, приходящееся на 100 г растворителя.
Молярная растворимость – количество моль растворенного вещества в одном литре растворителя.
Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом.
Величина взаимной растворимости веществ определяется их природой, а также внешними условиями (температура, давление).
Относительное содержание вещества в растворе называют концентрацией этого вещества. В зависимости от практического использования растворов применяют различные способы выражения концентрации:
Массовая доля (ω) – отношение массы растворенного вещества ( 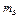 ) к массе раствора (
) к массе раствора (  ).
).

Массовый процент, процентная концентрация (  ).
).
 ,
,
где  - объем раствора (мл),
- объем раствора (мл), 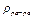 - плотность раствора (г/мл).
- плотность раствора (г/мл).
Молярная концентрация ( 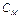 моль/л) – отношение числа моль растворенного вещества к объему раствора, выраженному в литрах.
моль/л) – отношение числа моль растворенного вещества к объему раствора, выраженному в литрах.
 , моль/л
, моль/л
Эквивалентная (нормальная) концентрация ( 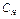 , экв/л) – отношение числа эквивалентов растворенного вещества к объему раствора, выраженному в литрах, т.е. число эквивалентов вещества в 1 л раствора.
, экв/л) – отношение числа эквивалентов растворенного вещества к объему раствора, выраженному в литрах, т.е. число эквивалентов вещества в 1 л раствора.
 , экв/л
, экв/л
Экспериментальная часть
Предварительные расчеты:
Например, найти объем 1% раствора  , необходимый для приготовления 200 мл (0,2 л) раствора с концентрацией
, необходимый для приготовления 200 мл (0,2 л) раствора с концентрацией  экв/л.
экв/л.

Рассчитаем 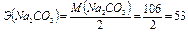 г/экв
г/экв
 г
г
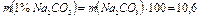 г.
г.
Так как 1%-ный раствор - сильно разбавленная система, примем его плотность равной 1 г/мл и вычислим объем.
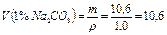 мл.
мл.
Ход работы:
1. Мерным цилиндром на 25 мл отобрать рассчитанный объем 1%-ного содового раствора (например, 10,6 мл).
2. Перенести пробу в мерную колбу объемом 200 мл и долить до метки дистиллированной водой.
3. Закрыть колбу пробкой, тщательно перемешать готовый раствор.
Установление точной концентрации полученного раствора
Для определения концентрации полученного раствора проводится титрование аналитической пробы раствором  с точно известной концентрацией
с точно известной концентрацией  экв/л.
экв/л.
1. Пробу раствора отобрать пипеткой (например, 20 мл) и перенести в коническую колбу для титрования.
2. Добавить 2-3 капли индикатора «метилоранж», раствор окрасится в желтый цвет.
3. Из бюретки по каплям при постоянном перемешивании добавлять раствор HCl до резкого изменения цвета с желтого на оранжевый (точка эквивалентности).
4. Отметить объем кислоты, пошедшей на титрование. Опыт провести 3 раза, результаты усреднить.
Например: 

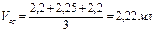

5. Рассчитать точную концентрацию содового раствора по формуле
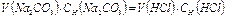
 экв/л
экв/л
6. Расчет ошибок.
Абсолютная ошибка 
Относительная ошибка 
Выводы:
1. Из 1% раствора соды приготовлен раствор с концентрацией  экв/л.
экв/л.
2. Установлена точная концентрация приготовленного раствора, равная 0,011 экв/л.
3. Относительная погрешность опыта составила 10%.
| <== предыдущая страница | | | следующая страница ==> |
| Опыт 3 | | | Лабораторная работа № 5 |
Дата добавления: 2015-06-30; просмотров: 208; Нарушение авторских прав

Мы поможем в написании ваших работ!