
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Комплексонометрия
Метод объемного анализа, в котором в качестве рабочих раст-воров (титрантов) используют растворы комплексонов, называется комплексонометрией. Метод применяют для определения концентрации ионов металлов в растворах, в том числе в биологических жидкостях, сточных водах и т. д.
В частности, комплексонометрию используют для определения общей жесткости воды. Жесткость воды, как известно, обусловлена присутствием солей кальция и магния - гидрокарбонатов, хлоридов, сульфатов, и др. Различают временную жесткость, вызванную нали-чием гидрокарбонатов, и постоянную, причиной возникновения которой является, в основном, присутствие хлоридов и сульфатов. Общая жесткость воды складывается из временной и постоянной жесткости и выражается суммарной молярной концентрацией эквивалента катионов Ca2+ и Mg2+ (ммоль/л). Использование жесткой воды приводит к образованию накипи в котлах и отопительных приборах, повышает расход моющих средств. Верхний предел жесткости воды в системах водоснабжения составляет, как правило, 7 ммоль/л.
Точку эквивалентности в методекомплексонометрии фиксируют при помощи металлоиндикаторов (эриохром черный Т, мурексид и др.). Металлоиндикаторы представляют собой однозамещенные соли слабых многоосновных органических кислот.
Так, эриохром черный Т имеет структуру:
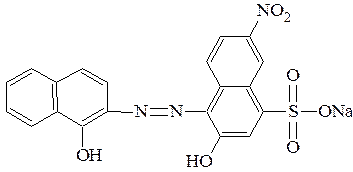
которую можно кратко представить как NaH2Ind.
Кислотность этого соединения обусловлена наличием фенольных групп, величины 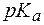 которых равны 7,7 и 9,5. В водных растворах этот индикатор может находится в виде трех форм, соотношение которых зависит от pH среды. Это находит отражение в изменении окраски раствора:
которых равны 7,7 и 9,5. В водных растворах этот индикатор может находится в виде трех форм, соотношение которых зависит от pH среды. Это находит отражение в изменении окраски раствора:
Н2Ind- ⇄ Н 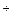 + HInd2- ⇄ 2Н
+ HInd2- ⇄ 2Н 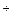 + Ind3-.
+ Ind3-.
красный синий желтый
(рН < 7) (pH = 7÷11) (pH > 11)
Отличительной особенностью этих соединений является способ-ность образовывать с ионами металлов окрашенные, малопрочные и растворимые в воде комплексы. Так, при добавлении эриохрома черного Т к водопроводной воде при рН = 7÷11 образуется красный комплекс индикатора с ионами Са2+ и Mg2+:
HInd2-(cиний) + Ca2+ ⇄ [CaInd]-(красный) + H+
HInd2-(cиний) + Mg2+ ⇄ [MgInd]-(красный) + H+
Образующиеся при этом ионы H+ нейтрализуются аммиачным буфером и в системе поддерживается постоянство pH на уровне 7÷11.
Полученные при этом комплексы характеризуются меньшей прочностью по сравнению с внутрикомплексными соединениями. Действительно, значения 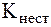 [MgInd]- и [MgTr]2- соответственно равны 2,8·105 и 5·108. Поэтому при добавлении трилона Б конкуренцию за ионы Ме2+ выигрывает комплексон, так при этом образуется более прочный комплекс:
[MgInd]- и [MgTr]2- соответственно равны 2,8·105 и 5·108. Поэтому при добавлении трилона Б конкуренцию за ионы Ме2+ выигрывает комплексон, так при этом образуется более прочный комплекс:
Ме2+ + H2Tr2- 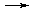 MeTr2- + 2H+
MeTr2- + 2H+
В точке эквивалентности ярко окрашенный комплекс металла с индикатором полностью разрушается и индикатор выделяется в индивидуальной форме:
МеInd- + H2Tr2- 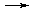 MeTr2- + HInd2- + H+,
MeTr2- + HInd2- + H+,
цвет которой определяется рН раствора.
Таким образом, если применять индикатор эриохром черный Т, то точку эквивалентности можно зафиксировать по переходу окраски раствора из красной в синюю.
| <== предыдущая страница | | | следующая страница ==> |
| Хелаты и внутрикомплексные соединения | | | Металлопротеины |
Дата добавления: 2015-06-30; просмотров: 266; Нарушение авторских прав

Мы поможем в написании ваших работ!