
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химическая сущность
NaCl + AgNO3 = AgCl ¯ + NaNO3
2AgNO3 + K2CrO4 = Ag2CrO4 ¯ + 2KNO3
| |||||||
| |||||||
 | |||||||
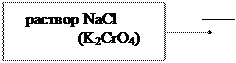 |
| При проведении определений по методу Мора независимо от того, что определяется (соли галогенов или соли серебра), всегда нужно к точному объему раствора соли галогена приливать раствор соли серебра из бюретки, т.к. только в этом случае получается резкое изменение окраски в конце титрования. | 
|
В первую очередь должен выделиться осадок AgCl и после того, как полностью ионы Cl- будут осаждены, от одной избыточной капли раствора AgNO3 должен образоваться осадок Ag2CrO4.
|

|
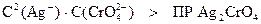
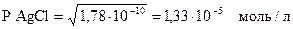
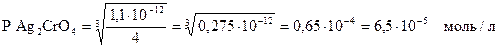
P AgCl < P Ag2CrO4
Следовательно, первым выпадает осадок AgCl.
В точке эквивалентности С (Ag+) = C (Cl-).

Концентрация ионов CrO42-, необходимая для достижения ПР Ag2CrO4, при этой концентрации ионов Ag+ составляет:
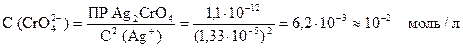
Значит концентрация K2CrO4 в растворе должна быть равной 0,01 моль/л.
Вычислим, какой объем K2CrO4 следует взять для анализа.
Пример. Сколько мл 10% K2CrO4 надо прилить к 20,00 мл раствора NaCl ?
В момент эквивалентности V (NaCl) = 20 мл, V (AgNO3) = 20 мл.
Общий объем раствора = 40 мл.
| Дано: С (CrO42-) = 0,01 моль/л V общ = 40,00 мл w (K2CrO4) = 10 % r (K2CrO4) = 1 г/ см3 M (K2CrO4) = 194,19 г/моль | Решение:
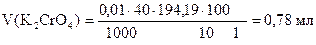 Практически берут 10 капель 10% раствора K2CrO4.
Осадок хромата серебра выпадает от одной избыточной капли раствора AgNO3.
Практически берут 10 капель 10% раствора K2CrO4.
Осадок хромата серебра выпадает от одной избыточной капли раствора AgNO3.
| |
| V (K2CrO4) = ? |
| <== предыдущая страница | | | следующая страница ==> |
| Практическое применение | | | Условия титрования по методу Мора |
Дата добавления: 2015-07-26; просмотров: 142; Нарушение авторских прав

Мы поможем в написании ваших работ!