
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Условия титрования по методу Мора
1. Титрование с K2CrO4 в качестве индикатора проводится в нейтральной или слабощелочной среде (рН = 6,5 - 10), т.к. Ag2CrO4 растворим в кислотах:
2Ag2CrO4 + 4HNO3 = 4AgNO3 + H2Cr2O7 + H2O ,
а при рН > 10 образуется оксид или гидроксид серебра:
2AgNO3 + 2NaOH = Ag2O ¯ + 2NaNO3 + H2O
В аммиачной среде осадок AgCl растворяется:
AgCl ¯ + 2NH3×H2O = [Ag(NH3)2]Cl + 2H2O
2. Отсутствие в исследуемом растворе катионов, дающих с CrO42- осадки (Ba2+, Pb2+, Bi3+ и др.).
3. Мешают анионы, образующие осадки с Ag+ (PO43-, AsO43-, C2O42- и др.).
4. Нельзя титровать окрашенные растворы.
2.1.3. Приготовление стандартного раствора и установка титра нитрата серебра
по методу Мора
1) Приготовление стандартного раствора AgNO3.

Навеску взвешивают на технических весах, растворяют в дистиллированной воде.
Хранят раствор AgNO3 в склянках из темного стекла, т.к. на свету соли серебра неустойчивы, титр AgNO3 изменяется.
2) Приготовление раствора NaCl из х.ч. соли.
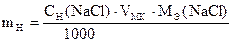
Навеску х.ч. NaCl взвешивают на аналитических весах, растворяют в дистиллированной воде в мерной колбе. Вычисляют точную концентрацию NaCl:

3) Приготовление индикатора (10% раствора K2CrO4).
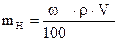
Навеску K2CrO4 взвешивают на технических весах, растворяют в дистиллированной воде.
4) Приготовление раствора "свидетеля".
В коническую колбу приливают аликвоту 10,00 мл раствора NaCl, 10 капель индикатора K2CrO4 и AgNO3 из бюретки до появления желтой окраски.
5) Установка точной концентрации раствора AgNO3 .
Аликвоту 10,00 мл раствора NaCl отбирают пипеткой, переносят в коническую колбу, прибавляют 10 капель индикатора и титруют стандартным раствором AgNO3, энергично перемешивают содержимое колбы. Титрование заканчивают в тот момент, когда цвет титруемого раствора начнет отличаться от цвета "свидетеля", появится слегка красноватый оттенок (начало выпадения Ag2CrO4).
Титрование повторяют три раза. Вычисляют Сн (AgNO3), Т(AgNO3), Т(AgNO3 /Cl-), К.

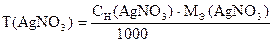
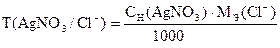

Примечание. Содержимое колбы после окончания титрования необходимо собирать в специально предназначенный сосуд "слив".
| <== предыдущая страница | | | следующая страница ==> |
| Химическая сущность | | | Метод Фаянса. Метод основан на прямом титровании галогенидов стандартным раствором AgNO3 в присутствии адсорбционных индикаторов |
Дата добавления: 2015-07-26; просмотров: 208; Нарушение авторских прав

Мы поможем в написании ваших работ!