
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лабораторная работа. Аргентометрическое титрование. Определение процентной концентрации изотонического раствора
Цель работы. Определить процентную концентрацию хлорида натрия в изотоническом растворе по методу Мора.
Реактивы. Нитрат серебра, 0,05 н. титрованный раствор; хлорид натрия, 0,1 н. титрованный раствор; 5 %-ный раствор хромата калия;
Определение хлорид-ионов основано на прямом титровании навески анализируемого вещества или его раствора стандартным раствором АgNО3 в присутствии индикатора – хромата калия или адсорбционного индикатора.
После выпадения белого осадка АgС1 в момент эквивалентности:
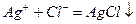
избыточная капля титранта АgNО3 образует с ионами СrО42- осадок Аg2СrО4, который и окрашивает содержимое колбы в кирпично-красный цвет.
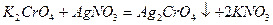
Титрование проводят в нейтральном растворе, так как Аg2СrО4 растворим в кислотах.
Ход анализа. 10,00 мл изотонического раствора перенести в мерную колбу вместимостью 100,0 мл, довести до метки дистиллированной водой, закрыть пробкой и тщательно перемешать. Аликвоту (Va=10,00 мл) приготовленного раствора помещают колбу для титрования, добавляют 10 мл дистиллированной воды, 3 – 5 капель 5 %-ного раствора хромата калия и титруют при энергичном перемешивании раствором АgNО3 до тех пор, пока не появится первое неисчезающее окрашивание суспензии в слабый красновато-коричневый цвет (до перехода окраски содержимого колбы от лимонно-желтой окраски до темно-розовой окраски).
Рассчитайте содержание хлорида натрия в исследуемом растворе. Результаты внесите в таблицу.

Vк – объем колбы (100,0мл), Vп – объем пипетки (10,00 мл),
ρ – плотность изотонического раствора (1г/см3), М – молярная масса.
Таблица.
Результаты титриметрического анализа изотонического раствора
| № пробы | Объем раствора, мл | Концентрация раствора | |||
| АgNО3 (V) | NaCl (Va) | АgNО3, | NaCl | ||
| Молярная (С), моль/л, | Молярная (С), моль/л | Процентная (ω), % | |||
Вопросы и задачи для защиты темы «Осадительное титрование»
1. Какие реакции лежат в основе метода осаждения? Какие требования к ним предъявляются? Классификация методов осаждения.
2. Каким условиям должна отвечать реакция в методах осадительного титрования?
3. Какие типы индикаторов применяются в осадительном титровании? Какие реакции лежат в основе метода Мора, Фаянса, Фольгарда?
4. Каков физический смысл термодинамического и концентрационного произведения растворимости?
5. Что такое растворимость? Какова связь между растворимостью и произведением растворимости?
6. Какие факторы влияют на растворимость?
7. Что такое «солевой эффект»?
8. На чем основано применение хромата калия в качестве индикатора при титровании хлоридов раствором нитрата серебра? Почему нельзя проводить количественное определение по методу Мора а) в кислой среде, б) в щелочной среде?
9. На чем основано применение железоаммонийных квасцов в качестве индикатора?
10. Каков механизм действия адсорбционных индикаторов в аргентометрии? Какие вещества применяются в качестве адсорбционных индикаторов?
11. Как можно приготовить титрованные растворы аргентометрического метода?
12. В чем сущность тиоцианометрического (роданометрического) метода определения серебра и галогенидов? Какие реакции лежат в основе этого метода?
13. Какие реакции положены в основу меркурометрического метода. Стандартные растворы метода и индикаторы.
14. В каких координатах строят кривую титрования?
15. Каков механизм действия индикаторов метода Фаянса?
16. Как готовят, устанавливают концентрацию и хранят рабочий раствор AgNO3?
17. Каковы достоинства и ограничения методов аргентометрии и меркурометрии?
Задачи
1. К 100,0 см3 0,1М раствора NaCl добавлены следующие объемы (см3) раствора AgNO3 такой же концентрации: а) 99,9; б) 100,0; в) 100,1. Вычислить рAg и рCl. ПР (AgCl)=1,8·10-10.
2. К 25,00 см3 0,1М раствора AgNO3 добавлены следующие объемы (см3) 0,1М раствора NaCl а) 24,0; б) 25,0; в) 26,0. Вычислить рAg и рCl. ПР (AgCl)=1,8·10-10.
3. К 100,0 см3 0,1М раствора KBr добавлены следующие объемы (см3) раствора AgNO3 такой же концентрации: а) 99,9; б) 100,0; в) 100,1. Вычислить рAg и рBr. ПР (AgBr)=5,3·10-13.
4. Рассчитать рAg и рBr при добавлении к 25,0 см3 0,015М раствора бромида натрия 20,00 см3 0,010М раствора AgNO3 . ПР (AgBr)=5,3·10-13.
5. Вычислить рAg и рI при добавлении к 20,00 см3 0,050М раствора NaI 20,00 см3 0,025М раствора AgNO3. ПР (AgI)=8,3·10-17.
6. Найти рAg и рCl при добавлении к 50,00 см3 0,020М раствора NaCl 20,00 см3 0,025М AgNO3. ПР (AgCl)=1,8·10-10.
7. Рассчитать рAg и рSCN при добавлении к 25,0 см3 0,050М раствора AgNO3 20,00 см3 0,025М раствора KSCN.
8. Вычислить рAg и рSCN в точке стехиометричности при титровании раствора AgNO3 раствором KSCN. ПР(AgSCN)=4,9·10-13.
9. Вычислить рAg и рI при добавлении к 25,0 см30,025М раствора NaI следующих объемов (см3) раствора AgNO3 такой же концентрации: а) 24,0; б) 25,0; в) 26,0. ПР (AgI)=8,3·10-17.
10. Найти рAg и рCl при добавлении к 25,00 см3 0,050М раствора NaCl 20,00 см3 0,025М AgNO3. ПР (AgCl)=1,8·10-10.
11. Вычислить рAg и рI при добавлении к 25,00 см3 0,020М раствора NaI 20,00 см3 0,020М раствора AgNO3. ПР (AgI)=8,3·10-17.
12. К 25,0 см3 0,1М раствора KBr добавлены следующие объемы (см3) раствора AgNO3 такой же концентрации: а) 24,9; б) 25,0; в) 25,1. Вычислить рAg и рBr. ПР (AgBr)=5,3·10-13.
13. К 50,00 см3 0,1М раствора AgNO3 добавлены следующие объемы (см3) 0,1М раствора NaCl а) 24,0; б) 50,0; в) 50,1; г) 51,0. Вычислить рAg и рCl. ПР (AgCl)=1,8·10-10.
14. К 100,0 см3 0,1М раствора KSCN добавлены следующие объемы (см3) раствора AgNO3 такой же концентрации: а) 99,9; б) 100,0; в) 100,1. Вычислить рAg и рSCN. ПР(AgSCN)=4,9·10-13.
15. К 25,00 см3 0,025М раствора AgNO3 добавлены следующие объемы (см3) 0,025М раствора NaCl а) 24,0; б) 25,0; в) 26,0. Вычислить рAg и рCl. ПР (AgCl)=1,8·10-10.
16. Сколько [A1] граммов BaCl2 (хч) необходимо взять для приготовления 1000,0 мл раствора с титром 0,006492 г/мл? Рассчитайте молярную и моль-эквивалентную концентрации полученного раствора.
17. Сколько граммов KCl содержится в 100,0 мл раствора, если на титрование 20,0 мл раствора затрачено 18,0 мл 0,0590 М AgNO3?
18. Сколько миллиграммов сульфат-иона содержится в 1,0 л минеральной воды, если на титрование 50,0 мл воды израсходовано 4,8 мл 0,04836 н раствора BaCl2?
19. Рассчитайте молярную концентрацию и титр раствора AgNO3, если на титрование 25,0 мл 0,10 М NaCl затрачено 10,4 мл AgNO3.
20. Рассчитайте молярную концентрацию и титр раствора BaCl2, если на титрование 20,0 мл раствора хлорида бария затрачено 8,7 мл 0,12 н раствора Na2SO4.
21. Сколько миллилитров 0,12 н AgNO3 потребуется на титрование 10,0 мл раствора KCl, содержащего 7,46 г в 500,0 мл?
22. Чему равен титр раствора нитрата серебра, если на титрование 25,0 мл затрачено 15,5 мл раствора хлорида натрия. Известно, что в 500,0 мл раствора содержится 58г NaCl.
23. Навеску технического бромида калия массой 0,1098 г растворили, после чего оттитровали 15,4 мл 0,05 Мэкв раствора нитрата серебра. Вычислить процентное содержание бромида калия в образце.
24. Определить процентное содержание серебра в сплаве, если после растворения 0,1540 г навески сплава на титрование израсходовано 21,4 мл раствора KСl. Содержание хлорида калия в растворе 0,2711 г в 100,0 мл.
25. Рассчитать моль-эквивалентную концентрацию Hg2(NO3)2 , если на титрование 0,1050 г хлорида натрия пошло 20,0 мл Hg2(NO3)2.
26. Навеску смеси хлорида и нитрата натрия массой 0,8180 г растворили в мерной колбе вместимостью 200,0 мл. На титрование 20,0 мл раствора израсходовали 18,3 мл раствора нитрата серебра (TAgNO3/KCl=0,003442 г/мл). Вычислить процентное содержание хлорида натрия и нитрата натрия в смеси.
27. На титрование раствора NaCl затрачено 10,50 мл 0,0100 моль/л раствора AgNO3. Вычислить массу навески (г) хлорида натрия в растворе.
28. Навеску серебряного сплава массой 1,745г растворили в HNO3 и раствор разбавили водой до объема 200,00 мл. На титрование 10,00 мл раствора потребовалось 11,75мл 0,05 М KSCN (К=0,9344). Вычислить массовую долю (%) серебра в сплаве.
29. Навеску технического КBr массой 0,3838г оттитровали 23,80 мл раствора AgNO3 [Т(AgNO3/Cl)=0,003546 г/мл]. Вычислить массовую долю (%) КBr в образце.
30. Определить молярную концентрацию эквивалента, титр AgNO3 и титр по определяемому веществу (T AgNO3/NaI), если на титрование 0,1394 г NaCl израсходовалось 21,74 мл AgNO3
31. В мерной [A2] колбе на 250 мл растворили 3,036г технического KCl. К 25 мл раствора прибавили 50 мл 0,1045 М AgNO3. На титрование избытка AgNO3 израсходовали 20,68 мл раствора NH4CSN (Т NH4CSN/Ag = 0,01156). Вычислить массовую долю KCl в образце.
32. Навеску поваренной соли массой 0,116г перевели в раствор и обработали 50 мл 0,0654 М раствора нитрата серебра. На титрование избытка нитрата серебра израсходовали 24,85 мл 0,05 М роданида калия (К=1,050). Вычислить массовую долю хлорида натрия в пробе.
33. Навеску 0,1268 г смеси хлористых солей растворили и обработали 50,0 мл 0,09 МAgNO3. На титрование избытка AgNO3 израсходовали 23,9 мл 0,11 Мэкв KSCN. Вычислить процентное содержание хлорида в образце.
34. В мерной колбе на 500,0 мл растворили 5,3000 г технического хлорида калия. К 25,0 мл раствора прибавили 50,0 мл 0,1 Мэкв раствора нитрата серебра. На титрование избытка нитрата серебра расходуется 23,8 мл раствора тиоционата аммония с титром по серебру TNH4SCN/Ag = 0,010680 г/мл. Вычислить процентное содержание хлорида калия в образце.
35. В мерной колбе на 250 мл растворили 3,0360г технического KCl. К 25 мл раствора прибавили 50 мл 0,1045 М AgNO3. На титрование избытка AgNO3 израсходовали 20,68 мл раствора NH4CSN (ТNH4CSN/Ag = 0,01156г/мл). Вычислить массовую долю KCl в образце.
36. Навеску поваренной соли массой 0,1160 г перевели в раствор и обработали 50,00 мл 0,06540 М AgNO3. На титрование избытка AgNO3 израсходовали 21,20 мл раствора KSCN. Вычислить массовую долю (%)NaCl в пробе.
37. Навеску смеси хлористых солей массой 0,1630г растворили и обработали 50,00мл раствора AgNO3 (Т=0,01721 г/мл). На титрование избытка AgNO3 израсходовали 23,40мл 0,1М KSCN (К=0,8932). Вычислить массовую долю хлорида в смеси.
38. К раствору, содержащему 0,2266 г технического хлорида магния, прилили 25,00 мл 0,1121 М AgNO3, избыток которого оттитровали 11,10 мл 0,0579 М NH4SCN. Вычислить массовую долю (%) MgCl2 в образце.
39. Навеску технического NaBr массой 0,2058 г растворили в воде, к раствору прибавили 40,00 мл 0,09980 М AgNO3. На титрование избытка AgNO3израсходовали 21,20 мл раствора KSCN. Вычислить массовую долю (%) примесей в образце, если 1,00 мл раствора AgNO3 эквивалентен 1,06 мл раствор KSCN.
40. В мерной колбе вместимостью 250,0 мл растворили 2,2002 г технического КВг. К 25,00 мл раствора прибавили 50,00 мл 0,05560 М AgNO3. На титрование избытка AgNO3 израсходовали 21,02 мл раствора NH4SCN (T=0,003522). Вычислить массовую долю (%) КВг в образце.
41. Навеску хлорида в 1,4790г растворена в мерной колбе на 250,0 см3. К 25,0 см3 полученного раствора добавили 50,0 см3 раствора AgNO3 (К=0,9580 к 0,1н). На титрование избытка AgNO3 израсходовали 25,50 см3 раствора NH4SCN (К=1,1200 к 0,1н). Вычислить массовую долю (%) хлора в хлориде.
42. К раствору вещества (0,2266 г) содержащему хлорида, прибавили 30,00 см3 0,1121н раствора AgNO3, а затем избыток AgNO3 оттитровали 0,50 см3 0,1158н раствора Рассчитать процент по массе хлора в анализируемом веществе.
43. Рассчитайте массовую долю (%) хлора в хлорацетофеноне С6Н5СОСН2С1, если к его навеске массой 0,3134 г после разложения добавили 25,00 мл раствора AgNO3 с молярной концентрацией 0,1000 моль/л, на титрование избытка которого затратили 10,55 мл раствора КSCN с молярной концентрацией 0,0500 моль/л. М(С6Н5СОСН2С1 = 154,60 г/моль). Ответ: 22,31 %
44. Навеска технического хлорида натрия (m=1,1622г) растворена в в мерной колбе на 200,0 см3. К 20,0 см3 полученного раствора добавили 25,0 см3 раствора AgNO3 0,1н. На титрование избытка раствора AgNO3 израсходовали 5,80 см3 раствора NH4SCN. Вычислить массовую долю (%) хлорида натрия в образце.
45. Для определения хлоридов в молоке методом Фольгарда к 10,00 см3 пробы молока добавлено 15,00 см3 0,02817М раствора AgNO3, избыток которого оттитровали 1,15 см3 0,02817М раствора КSCN. Вычислить хлоридов в 100 см3молока.
[A1]титрование
[A2]осадительное титрование
| <== предыдущая страница | | | следующая страница ==> |
| Опыт 2. Приготовление стандартного раствора хлорида натрия | | | Проблемная ситуация |
Дата добавления: 2015-07-26; просмотров: 543; Нарушение авторских прав

Мы поможем в написании ваших работ!