
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Взаимодействие металлов с кислотами. По характеру действия на металлы наиболее распространенные кислоты можно разделить на две группы
По характеру действия на металлы наиболее распространенные кислоты можно разделить на две группы.
1. Кислоты-неокислители: хлороводородная (соляная, HCl), бромоводородная (HBr), йодоводородная (HI), фтороводородная (HF), уксусная (CH3COOH), разбавленная серная (H2SO4 (разб.)), разбавленная ортофосфорная (H3PO4 (разб.)).
2. Кислоты-окислители: азотная (HNO3) в любой концентрации, концентрированная серная (H2SO4 (конц.)), концентрированная селеновая (H2SeO4(конц.)) .
Взаимодействие металлов с кислотами-неокислителями. Окисление металлов ионами водорода H+ в растворах кислот-неокислителей происходит более энергично, чем в воде.
Все металлы, имеющие отрицательное значение стандартного электродного потенциала, т.е. находящиеся в электрохимическом ряду напряжений до водорода, вытесняют водород из кислот-неокислителей. Реакция протекает по схеме:
Ме + nH + = Men+ + n/2 H2 .
Например:
2Al +6HCl = 2AlCl3 + 3H2 ,
Mg + 2CH3COOH = Mg(CH3COO)2 + H2 ,
2Ti + 6HCl = 2TiCl3 + 3H2 .
Металлы с переменной степенью окисления (Fe, Cо, Ni и др.) образуют ионы в своей низшей степени окисления (Fe2+, Co2+, Ni2+ и другие):
Fe + H2SO4 (разб) = FeSO4 + H2.
При взаимодействии некоторых металлов с кислотами-неокислителями: HCl, HF, H2SO4 (разб.), HCN образуются нерастворимые продукты, предохраняющие металл от дальнейшего окисления. Так, поверхность свинца в HCl (разб) и H2SO4(разб) пассивируется плохо растворимыми солями PbCl2 и PbSO4 соответственно.
Взаимодействие металлов с кислотами-окислителями. Серная кислота в разбавленном растворе – слабый окислитель, а в концентрированном – очень сильный. Окисляющая способность концентрированной серной кислоты H2SO4 (конц.) определяется анионом SO42-, окислительный потенциал которого значительно выше, чем иона H+. Концентрированная серная кислота является сильным окислителем за счёт атомов серы в степени окисления (+6). Кроме того, в концентрированном растворе H2SO4 содержится мало ионов H+, так как в концентрированном растворе она слабо ионизирована. Поэтому при взаимодействии металлов с H2SO4 (конц.) водород не выделяется.
Реагируя с металлами как окислитель, H2SO4 (конц.) переходит чаще всего в оксид серы (IV) (SO2), а при взаимодействии с сильными восстановителями – в S или H2S:
Me + H2SO4 (конц) ® Me2(SO4)n + H2O + SO2 (S, H2S).
Для удобства запоминания рассмотрим электрохимический ряд напряжений, который выглядит так:
Li, Rb, K, Cs, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au .
В табл. 1. представлены продукты восстановления концентрированной серной кислоты при взаимодействии с металлами различной активности.
Таблица 1.
Продукты взаимодействия металлов с концентрированной
серной кислотой
| Тип металла | Продукты восстановления H2SO4 (конц.) |
| Малоактивные металлы (в ряду напряжений правее Fe) | SO2 |
| Металлы, стоящие в ряду напряжений между Al и Cd | Возможно образование трёх продуктов: SO2, S, H2S |
| Активные металлы (начало ряда напряжений по Al включительно) | H2S |
Примеры:
Cu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O,
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O.
Для металлов средней активности (Mn, Cr, Zn, Fe) соотношение продуктов восстановления зависит от концентрации кислоты.
Общая тенденция такова: чем выше концентрация H2SO4 , тем глубже протекает восстановление.
Это означает, что формально каждый атом серы 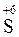 из молекул H2SO4 может забрать у металла не только два электрона (и перейти в
из молекул H2SO4 может забрать у металла не только два электрона (и перейти в 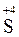 ), но и шесть электронов (и перейти в
), но и шесть электронов (и перейти в 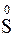 ) и даже восемь (и перейти в
) и даже восемь (и перейти в 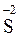 ):
):
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O,
3Zn + 4H2SO4 (конц) = 3ZnSO4 + S + 4H2O,
4Zn + 5H2SO4 (конц) = 4ZnSO4 + H2S + 4H2O.
Свинец с концентрированной серной кислотой взаимодействует с образованием растворимого гидросульфата свинца (II), оксида серы (IV) и воды:
Pb + 3H2SO4 = Pb(HSO4)2 + SO2↑ + 2H2O.
Холодная H2SO4 (конц) пассивирует некоторые металлы (например, железо, хром, алюминий), что позволяет перевозить кислоту в стальной таре. При сильном нагревании концентрированная серная кислота взаимодействует и с этими металлами:
2Fe + 6H2SO4 (конц) 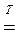 Fe2(SO4)3 + 3SO2 + 6H2O.
Fe2(SO4)3 + 3SO2 + 6H2O.
Взаимодействие металлов с азотной кислотой.Окислительная способность азотной кислоты определяется анионом NO3-, окислительный потенциал которого значительно выше, чем ионов H+. Поэтому при взаимодействии металлов с HNO3 водород не выделяется. Нитрат-ион NO3- , имеющий в своём составе азот в степени окисления (+ 5), в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- может протекать с образованием различных веществ по следующим схемам:
NO3- + 2H+ + e = NO2 + H2O,
NO3- + 4H+ + 3e = NO + 2H2O,
2NO3- + 10H+ + 8e = N2O + 5H2O,
2NO3- + 12H+ + 10e = N2 + 6H2O,
NO3- + 10H+ + 8e = NH4+ + 3H2O.
Азотная кислота обладает окислительной способностью при любой концентрации. При прочих равных условиях проявляются следующие тенденции: чем активнее металл, реагирующий с кислотой, и чем меньше концентрация раствора азотной кислоты, тем более глубоко она восстанавливается.
Это можно пояснить следующей схемой:
 |
Окисление веществ азотной кислотой сопровождается образованием смеси продуктов её восстановления (NO2, NO, N2O, N2, NH4+), состав которых определяется природой восстановителя, температурой и концентрацией кислоты. Среди продуктов преобладают оксиды NO2 и NO. Причём при взаимодействии с концентрированным раствором HNO3 чаще выделяется NO2, а с разбавленной – NO.
Уравнения окислительно-восстановительных реакций с участием HNO3 составляются условно, с включением только одного продукта восстановления, образующегося в большем количестве:
Me + HNO3 ® Me (NO3)n + H2O + NO2 (NO, N2O, N2, NH4+).
Например, в газовой смеси, образующейся при действии на достаточно активный металл цинк ( 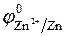 = - 0,76 B) концентрированной (68%-й) азотной кислоты, преобладает – NO2, 40%-й – NO; 20%-й – N2O; 6%-й – N2. Очень разбавленная (0,5%-я) азотная кислота восстанавливается до ионов аммония:
= - 0,76 B) концентрированной (68%-й) азотной кислоты, преобладает – NO2, 40%-й – NO; 20%-й – N2O; 6%-й – N2. Очень разбавленная (0,5%-я) азотная кислота восстанавливается до ионов аммония:
Zn + 4HNO3 (конц.) = Zn(NO3)2 + 2NO2 + 2H2O,
3Zn + 8HNO3 (40%) = 3Zn(NO3)2 + 2NO + 4H2O,
4Zn + 10HNO3 (20%) = 4Zn(NO3)2 + N2O + 5H2O,
5Zn + 12HNO3 (6%) = 5Zn(NO3)2 + N2 + 6H2O,
4Zn + 10HNO3 (0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O.
С малоактивными металлом медью ( 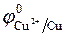 = + 0,34B) реакции идут по следующим схемам:
= + 0,34B) реакции идут по следующим схемам:
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2H2O,
3Cu + 8HNO3 (разб) = 3 Cu(NO3)2 + 2NO + 4H2O.
В концентрированной HNO3 растворяются практически все металлы, кроме Au, Ir, Pt, Rh, Ta, W, Zr. А такие металлы как Al, Be, Bi, Co, Cr, Fe, Nb, Ni, Pb, Th, U, а также нержавеющие стали пассивируются кислотой с образованием устойчивых оксидных плёнок, плотно прилегающих к поверхности металла и защищающих его от дальнейшего окисления. Однако Al и Fe начинают растворяться при нагревании, а Cr устойчив к действию даже горячей HNO3:
Fe + 6HNO3 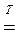 Fe(NO3)3 + 3NO2 + 3H2O.
Fe(NO3)3 + 3NO2 + 3H2O.
Металлы, для которых характерны высокие степени окисления (+6, +7, +8), с концентрированной азотной кислотой образуют кислородсодержащие кислоты. При этом HNO3 восстанавливается до NO, например:
3Re + 7HNO3 (конц) = 3HReO4 + 7NO + 2H2O.
В очень разбавленной HNO3 уже отсутствуют молекулы HNO3, существуют только ионы H+ и NO3-. Поэтому очень разбавленная кислота (~ 3-5%) взаимодействует с Al и не переводит в раствор Cu и другие мало активные металлы:
8Al + 30HNO3 (очень разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O.
Смесь концентрированных азотной и соляной кислот (1:3) называется царской водкой. Она растворяет Au и платиновые металлы (Pd, Pt, Os, Ru). Например:
Au + HNO3 (конц.) + 4HCl = H[AuCl4] + NO + 2H2O.
Указанные металлы растворяются в HNO3 и в присутствии других комплексообразователей, но процесс протекает очень медленно.
| <== предыдущая страница | | | следующая страница ==> |
| Взаимодействие металлов с водой | | | Примеры решения задач. Задача 1. Напишите уравнения реакций взаимодействия между следующими веществами |
Дата добавления: 2015-07-26; просмотров: 379; Нарушение авторских прав

Мы поможем в написании ваших работ!