
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Примеры решения задач. Задача 1. Напишите уравнения реакций взаимодействия между следующими веществами
Задача 1. Напишите уравнения реакций взаимодействия между следующими веществами:
а) железом и соляной кислотой;
б) магнием и концентрированной серной кислотой;
в) железом и разбавленной азотной кислотой.
Решение. а) В результате взаимодействия железа с соляной кислотой образуется хлорид железа (II) и выделяется водород:
Fe + 2HCl = FeCl2 + H2↑.
б) При взаимодействии магния с концентрированной серной кислотой образуется сульфат магния, вода и продукт восстановления серной кислоты – сероводород:
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O.
в) Железо с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты, например:
Fe + 4HNO3 (разб) = Fe(NO3)3 + NO + 2H2O.
Задача 2. Записать уравнения реакций, с помощью которых можно осуществить следующие превращения:
CuSO4 ® Cu ® Cu(NO3)2 ® Cu(OH)2 ® CuO® CuSO4 .
Решение. 1. Медь образуется при восстановлении сульфата меди (II) более активным металлом, например, цинком:
CuSO4 + Zn = ZnSO4 + Cu.
2. При действии концентрированного раствора азотной кислоты медь превращается в нитрат меди (II):
Сu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2Н2О .
3. При действии на нитрат меди (II) раствора NaOH образуется гидроксид меди (II):
Cu(NO3)2 + 2NaOH = Cu(OH)2↓+ 2NaNO3.
4. При нагревании гидроксид меди (II) разлагается:
Cu(OH)2 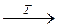 CuO + Н2О.
CuO + Н2О.
5. При действии на оксид меди (II) разбавленного раствора H2SO4 образуется сульфат меди (II):
CuO + H2SO4 (разб) = CuSO4 + H2O.
Задачи
1. Составить электронные формулы и электроно-графические диаграммы внешнего и предвнешнего энергетических уровней атома металла и его иона в основном состоянии. Указать число неспаренных электронов у атома и иона.
| Вариант | Металл | Ион металла | Вариант | Металл | Ион металла |
| Sc | Sc3+ | Ti | Ti3+ | ||
| Cr | Cr3+ | Ni | Ni2+ | ||
| Mn | Mn3+ | Y | Y+3 | ||
| Sr | Sr2+ | Cu | Cu2+ | ||
| Ga | Ga3+ | Mo | Mo2+ | ||
| Fe | Fe3+ | Hg | Hg2+ | ||
| Mo | Mo3+ | Cd | Cd2+ |
2. Написать уравнения реакций взаимодействия указанных металлов с водой или водным раствором сильного основания. Расставить стехиометрические коэффициенты методом электронного баланса.
| Вариант | Металл | Реагент | Вариант | Металл | Реагент |
| Ca | H2O | Cs | H2O | ||
| Al | NaOH | Mg | H2O | ||
| K | H2O | Sn | NaOH | ||
| Ba | H2O | Sr | H2O | ||
| Zn | NaOH | Be | KOH | ||
| Sn | KOH | Rb | H2O | ||
| Be | NaOH | Li | H2O |
3. Написать уравнения реакций взаимодействия металлов с кислотами при комнатной температуре или при нагревании (T). Расставить стехиометрические коэффициенты методом электронного баланса.
| Вариант | Металл | Кислота | Вариант | Металл | Кислота |
| Fe | HNO3 (разб) | Mg | H2SO4 (конц) | ||
| Cr | H2SO4 (разб) | Mn | H2SO4 (конц) | ||
| Mn | H2SO4 (разб) | Fe | H2SO4 (конц) (T) | ||
| Co | HNO3 (разб) | Ni | HNO3 (разб) | ||
| Fe | HNO3 (конц) (T) | Al | HNO3 (оч. разб) | ||
| Ni | H2SO4 (конц) (T) | Mn | HNO3 (разб) | ||
| Co | H2SO4 (разб) | Fe | H2SO4 (разб) |
4. Написать уравнения реакций взаимодействия указанных металлов с водным раствором соли. Расставить стехиометрические коэффициенты методом электронного баланса.
| Вариант | Металл | Реагент | Вариант | Металл | Реагент |
| Sn | AgNO3 | Fe | Pb(NO3)2 | ||
| Ni | CuSO4 | Cd | SnSO4 | ||
| Zn | FeSO4 | Co | AgNO3 | ||
| Ag | AuCl3 | Sn | Cu(NO3)2 | ||
| Ti | CdCl2 | Cu | HgCl2 | ||
| Cu | AgNO3 | Ag | PdCl2 | ||
| Zn | AuCl3 | Mn | CdSO4 |
| <== предыдущая страница | | | следующая страница ==> |
| Взаимодействие металлов с кислотами. По характеру действия на металлы наиболее распространенные кислоты можно разделить на две группы | | | События. Для чего же существуют события |
Дата добавления: 2015-07-26; просмотров: 314; Нарушение авторских прав

Мы поможем в написании ваших работ!