
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кривая титрования слабого основания сильной кислотой
Начальная точка такой кривой характеризует равновесие в растворе слабого основания. Если титруется аммиак, то рН раствора будет определяться равновесием:
NH3 + НОН = NH4+ + ОН-
Концентрацию ОН--ионов в 0,1 М растворе NH3 можно вычислить по формуле:
 .
.
Отсюда,  моль/л,
моль/л,
откуда  моль/л и рН= 11,12.
моль/л и рН= 11,12.
До ТЭ смесь из неоттитрованного слабого основания и образовавшейся соли представляет собой буферный раствор.
Его рН может быть рассчитан по уравнению
 ,
,
где cS – общая концентрация соли, которая может быть приравнена к [СН3СОО-]; cА – равновесная концентрация кислоты, которая может быть приравнена к общей концентрации [СН3СООН].
 .
.
В точке эквивалентности в растворе только соль сильной кислоты и слабого основания, подвергающаяся гидролизу. В результате происходит накопление H+ и образование кислой среды раствора.
Концентрация ионов водорода в этом растворе

После точки эквивалентностирН раствора определяется количеством добавленной кислоты.

Кривая титрования 100,0 мл 0,1М NH3 0,1М раствором HCl выглядит следующим образом:
Здесь можно отметить плавное уменьшение рН в ходе титрования и скачок в области точки эквивалентности. Скачок титрования полностью находится в кислой области.
Точка эквивалентности расположена при рН 5,12 и не совпадает с точкой нейтральности.
Индикаторы и индикаторные ошибки при титровании слабого основания
Из трех индикаторов наиболее подходящим для титрования аммиака будет метиловый оранжевый, имеющий рТ 4,0, а наименее подходящим – фенолфталеин, обесцвечивание которого произойдет задолго до точки эквивалентности. В недотитрованных растворах слабого основания, когда рТ больше, чем рН в точке эквивалентности, необходимо контролировать щелочную ошибку титрования, а в перетитрованных растворах – водородную, или Н+-ошибку.
Щелочная ошибка, или МОН-ошибка определяется по формуле:

Если вместо Кb использовать обычно проводимую в современных справочниках константу диссоциации сопряженной кислоты КНА,связанную с Кb, то можно записать:

где [МОН] – концентрация неоттитрованного основания; [М+] – концентрация оттитрованного основания.
Титрование с бромтимоловым синим заканчивается при рН 7,2. Поскольку при титровании аммиака в точке эквивалентности рН 5,12 будет сделана МОН-ошибка:  , т.е. индикаторная ошибка в этом случае составит примерно 1%.
, т.е. индикаторная ошибка в этом случае составит примерно 1%.
У метилового оранжевого рТ 4,0, поэтому при титровании с этим индикатором раствор аммиака будет перетитрован, и, таким образом, сделана Н+-ошибка, рассчитываемая по формуле:

Отсюда,  .
.
Следовательно, метиловый оранжевый является вполне подходящим индикатором.
Титрование слабых кислот и слабых оснований возможно только при условии, если их Кдис > 10-7…10-8. При Кдис £ 10-9 скачок титрования на кривой титрования отсутствует и зафиксировать ТЭ в реальном титровании невозможно.
Титрование многоосновных кислот и оснований, а также смесей кислот или оснований
В растворах многоосновных кислот (оснований), так же как и в смеси кислот (оснований), диссоциация более слабых электролитов подавлена более сильными. Поэтому при добавлении сильного основания к смеси кислот оттитровывается прежде всего сильная и только, когда оставшегося количества ее не хватает для подавления диссоциации более слабой, начинается ее титрование. При этом если последовательные константы кислотности различаются более, чем в 104 раз, то на кривых титрования наблюдаются отчетливые скачки титрования. В противном случае скачки сливаются.
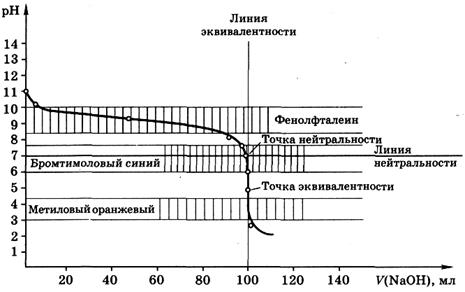
Кривая титрования 0,1М H2SO3 0,1М раствором NaOH с индикаторами фенолфталеином (ФФ) и метиловым оранжевым (МО) выглядит следующим образом:

Рассмотрим в качестве примера титрование кислоты с различающимися скачками.
Пусть 10 мл0,10 М (1/2H2SO3) (Ка,1 = 1,3·10-2, Kа,2 = 6,8·10-8) титруют 0,10 М NaOH. Построим таблицу значений рН:

Рассуждая аналогично, можно построить кривую титрования многоосновного основания.
На величину скачка титрования влияют все факторы, от которых зависят значения рН: константа диссоциации титруемого вещества, концентрации титруемого вещества и титранта, температура, ионная сила.
Чем слабее кислота, тем выше рН в начале титрования и в области буферного действия. Следовательно, ветвь кривой титрования до ТЭ смещается в щелочную область. В ТЭ образуется основание тем более сильное, чем слабее исходная кислота, следовательно, рН смещается также в щелочную область. В то же время ветвь за ТЭ остается неизменной. В целом скачок уменьшается:
Аналогично для оснований: чем слабее титруемое основание, тем скачок меньше и тем более он смещен в кислую область. Для кислот и оснований с k<5·10-8 ТЭ сливается с началом правой ветви кривой, т. е. скачок отсутствует. Так, нельзя оттитровать в водных растворах такие вещества, как Н3ВО3 (Ка = 5,6·10-10), NH4+ (Ка = 5,7·10-10), С2О42- (Ка = 1,7·10-10), C5H5N (Кb=1,5·10-9) и т. п.
Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты с с < 10-4 М, а слабые с с < 10-2 М.
При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температурыскачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно.
| <== предыдущая страница | | | следующая страница ==> |
| Кривая титрования слабой кислоты сильным основанием | | | Сутність поняття «особистості» в педагогічній науці |
Дата добавления: 2015-07-26; просмотров: 849; Нарушение авторских прав

Мы поможем в написании ваших работ!