
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кислотно-основные свойства аминокислот
Аминокислоты – амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (–СО2Н), так и основной (–NH2) группы в одной и той же молекуле.

В очень кислых растворах NH2-гpyппa аминокислоты протонируется, и эта кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
В твердом состоянии аминокислоты существуют в виде цвиттер-ионов (известных также под названием диполярных ионов или внутренних солей). В подобных цвиттер-ионах протон переносится от карбоксильной группы к аминогруппе.

Если поместить аминокислоту в среду, обладающую проводимостью, и опустить туда пару электродов, то в кислых растворах аминокислота будет мигрировать к катоду, а в щелочных растворах – к аноду. При некотором значении рН, характерном для данной аминокислоты, она не будет передвигаться ни к катоду, пи к аноду, так как каждая молекула находится в виде цвиттер-иона (иными словами, она несет как положительный, так и отрицательный заряды). Это значение рН называется изоэлектрической точкой (pI) данной аминокислоты (таблица 2). Изоэлектрическая точка аминокислот редко равна 7, так как зависит от кислотности иона алкиламмония, оснoвности карбоксилат-аниона, влияния на них радикала и присутствия любой дополнительной основной или кислотной группы.
При пропускании постоянного тока через раствор, содержащий смесь нескольких аминокислот, каждая из них будет двигаться к катоду или аноду со скоростью, зависящей от природы этой аминокислоты и от рН среды. Разделение и анализ смесей аминокислот, oснованные на этом явлении, называются электрофорезом.
2. Аминокислоты как биполярные ионы. Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группу H2NCHRCOOH, некоторые их свойства, как физические, так и химические, не согласуются с этой структурой:
· в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при довольно высокой температуре;
· они не растворимы в неполярных растворителях типа петролейного эфира, бензола или эфира и заметно растворимы в воде;
· их водные растворы ведут себя подобно растворам веществ с высоким дипольным моментом;
· константы кислотности и основности для групп СООН и NH2 необычайно малы.
Все эти свойства вполне соответствуют структуре диполярного иона для аминокислот H3N+–CHR–COO–. Физические свойства – температура плавления, растворимость, высокие дипольные моменты – отвечают ожидаемым для подобных солей. Кислотно-основные свойства также становятся понятными, если учесть, что измеряемая Ка в действительности относится к кислотности иона аммония RNH3+
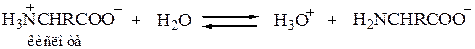

а Кb в действительности относится к основности карбоксилат-иона

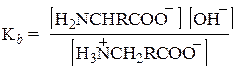
В водном растворе кислотность и основность кислоты и ее сопряженного основания (например, СН3СООН и СН3СОО– или СH3NH3+ и CH3NH2) связаны уравнением Ка·Кb = 10-14. На этом основании можно рассчитать, что Ка = 1,6×10–10 для NH3+-группы глицина означает Кb = 6,3×·10-5для NН2-группы, что кажется вполне приемлемой величиной для алифатического амина. Аналогично Кb = 2,5×10–12 для группы СОО– глицина означает, что Ка = 4×10–3 для СООН-группы, что кажется вполне приемлемой величиной для карбоновой кислоты, содержащей сильную электроноакцепторную (увеличивающую кислотность) NH3+-гpyппy.
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II; более сильное основание, гидроксил-ион, отрывает протон от иона аммония и вытесняет более слабое основание — амин
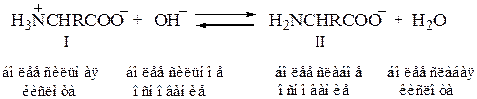
Если подкислить раствор аминокислоты, то диполярный ион I превращается в катион III; более сильная кислота Н3О+ отдает протон карбоксилат-иону и вытесняет более слабую карбоновую кислоту

Итак, кислой группой в простых аминокислотах типа глицина является не СООН–, a NH3-гpyппa, а основной — не NH2-гpyппa, а группа COО–.
Необходимо иметь в виду, что ионы II и III, содержащие свободную NH2- или СООН-группу, находятся в равновесии с диполярным ионом I; поэтому аминокислоты вступают в реакции, характерные для аминов и карбоновых кислот. По мере удаления иона II, например при реакции с бензоилхлоридом, равновесие сдвигается в сторону образования иона II, так что постепенно аминокислота полностью бензоилируется.
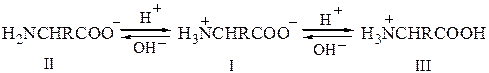
В тех случаях, когда это возможно, желаемую реакцию можно ускорить, создавая нужную концентрацию кислоты или основания в растворе так, чтобы увеличить концентрацию реакционноспособной частицы.
| <== предыдущая страница | | | следующая страница ==> |
| Получение аминокислот | | | Изоэлектрическая точка аминокислот |
Дата добавления: 2015-07-26; просмотров: 276; Нарушение авторских прав

Мы поможем в написании ваших работ!