
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Получение аминокислот
1. Получение α-аминокислот
1.1 Из природных веществ. Белки при гидролизе в водных растворах в присутствии кислоты дают смесь α-аминокислот, которые можно выделить и разделить. Все они оптически активны.
1.2 Получение из α-галогенкарбоновых кислот in vitro (аминирование или аммонолиз, реакция Геля–Фольгарда–Зелинского).Реакция протекает по механизму SN. Из галогенозамещенных кислот наиболее доступны α-галогенозамещенные кислоты, поэтому способ используется в основном для синтеза α-аминокислот.

1.3 Модифицированный метод синтеза при помощи малонового эфира обычно применяется для синтеза незамещенных кислот:
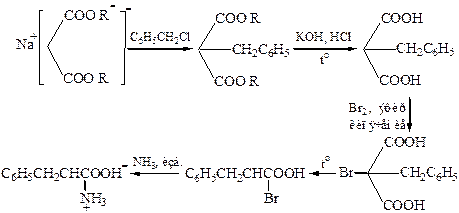
Галогенуглеводороды алкилирует ацетиламинмалоновый эфир:
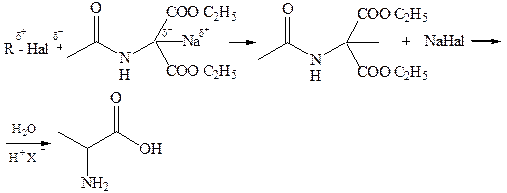
1.4 Аминирование эфиров α-галогензамещённых кислот (по Габриэлю) – фталимидный синтез:

1.5 Синтез Штреккера-Зелинского. Получение α-аминокислот из альдегидов (кетонов) путём действия на них синильной кислоты (или её соли) и аммиака (или NH4Cl).Вначале из альдегида, циановодородной кислоты и аммиака образуется α-аминонитрил, который затем гидролизуется в аминокислоту:

Синтез α-аминокислот по Штреккеру сводится к реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия. Это усовершенствование метода Штреккера предложено Н.Д. Зелинским и Г.Л. Стадниковым. В результате реакции этих неорганических веществ образуются аммиак и цианистый водород — «активные компоненты» процесса.
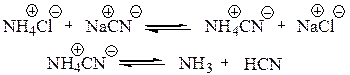
1.6 Восстановление оксимов, гидразонов и других азотсодержащих производных кислот:

1.7 Получение из нитросоединений (реакция Зинина). Ароматические аминокислоты получаются при восстановлении нитропроизводных ароматических кислот:
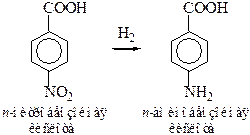
1.8 Гидролиз белков. При гидролизе белков обычно образуются сложные смеси аминокислот, однако с помощью специальных хроматографических методов из этих смесей можно выделять отдельные чистые аминокислоты. Так из гидролизатов природных белковых продуктов получают пролин, цистин, аргинин, гистидин.

1.9 Микробиологический способ. Ввиду сложности химического синтеза и в связи с трудностями разделения оптических изомеров некоторые аминокислоты получают с помощью микроорганизмов. К таким аминокислотам относят лизин (пищевой), триптофан, треонин.
2. Получение β-аминокислот
2.1. Получение из непредельных кислот.При взаимодействии α, β-ненасыщенных кислот с аммиаком образуются β-аминокислоты:

2.2. Способ Родионова В. М. Получение из малоновой кислоты и ацетата аммония, реакций с альдегидом:

3. Получение γ-, δ-, ε-, ω-аминокислот (специфические методы)
3.1.Щелочной гидролиз лактамов:

3.2.Перегруппировка оксимов (перегруппировка Бекмана):
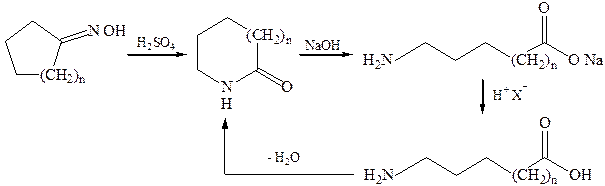
3.3.Присоединение аммиака к продуктам теломеризации, (оборванная цепная полимеризация с участием других соединений, образуется смесь продуктов различной массы) этилена и ССl4:

4. Получение аминоаренкарбоновых кислот:

5. Восстановление нитроаренкарбоновых кислот:
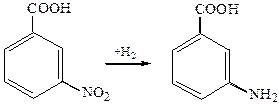
6. МетодГоффмана, для получения о-аминоаренкарбоновых кислот используют расщепление имидов:

Физические свойства.Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде, трудно растворимые в органических растворителях, с высокой температурой плавления (230–300ºС), с высокой плотностью. Аномально высокие температуры плавления аминокислот связаны с биполярной структурой их твердой фазы.
Таблица – 2 Физические свойства аминокислот
| Название | Тплав-ления, оС | (pI) | pКа | Раствори-мость в воде при 25 оС Г / 100 г | Удельное вращение L-ряда (S) [α]D25 (H2O) |
| Глицин | 5,97 | 2,34; 9,60 | |||
| Аланин | 6,02 | 2,35; 9,69 | 16,6 | +1,8 | |
| Валин | 5,97 | 2,32; 9,62 | 8,85 | +5,6 | |
| Лейцин | 5,98 | 2,36; 9,60 | 2,2 | –11 | |
| Изолейцин | 6,02 | 2,36; 9,68 | 4,12 | +12,4 | |
| Серин | 5,68 | 2,21; 9,15 | –7,5 | ||
| Треонин | 6,53 | 2,63; 10,43 | 20,5 | –28,5 | |
| Аспарагино-вая кислота | 2,97 | 2,09 (α-COOH) 3,86 (β-COOH) 9,82 | 0,5 | +5,0 | |
| Аспарагин | 5,41 | 2,02; 880 | 2,5 | –5,6 | |
| Глутамино-вая кислота | 3,22 | 2,19 (α-COOH) 4,25 (y-COOH) 9,67 | 0,84 | +12,6 | |
| Глутамин | 5,65 | 2,17; 9,13 | 4,2 | +6,3 | |
| Лизин | 9,74 | 2,18; 8,95(α-NH2) 10,53 (ε-NH2) | хорошо растворим | +13,5 | |
| Аргинин | 10,76 | 2,17; 9,04(α-NH2) 12,48 (ион гуанидия) | +12,5 | ||
| Гистидин | 7,58 | 1,82; 6,0 (имидазол); 9,17 | 4,3 | –38,5 | |
| Фенил-аланин | 5,98 | 1,83; 9,13 | –34,5 | ||
| Тирозин | 5,65 | 2,20; 9,11 (α-NH2) 10,07 (–OH) | –10 (5М HCl) | ||
| Триптофан | 5,88 | 2,38; 9,39 | 1,14 | –33,7 | |
| Цистеин | (хлор-гидрат) | 5,02 | 1,71; 8,33 (–SH) 10,78 (α-NH2) | хорошо растворим | –16,5 |
| Цистин | 5,06 | 1,65; 2,26 (COOH) 7,85; 9,85 (α-NH2) | 0,011 | –211,9 (1М HCl) | |
| Метионин | 5,75 | 2,38; 9,39 | 3,5 | –9,8 | |
| Пролин | 6,10 | 1,99; 10,60 | 16,2 | – | |
| Оксипролин | 5,83 | 1,92; 9,73 | 36,1 | – |
Аминокислоты лучше растворимы в воде, чем в органических растворителях (например, в этаноле, диэтиловом эфире). Эти свойства указывают на солеобразный характер аминокислот, который является следствием взаимодействия карбоксильных групп с аминогруппами. Многие α-аминокислоты имеют сладкий вкус.
Наличие в молекуле кислотной (-COOH) и основной (-NH2) групп создаёт возможность образования внутренних солей – бетаинов.

Карбоксильная группа находится в них в неионизированном состоянии.

В таком виде существуют и другие аминокислоты (α, β, γ, δ, …) кроме аминоаренкарбоновых кислот.
В водных растворах осуществляют равновесие между катионом и анионом бетаина.

Соотношение определяется константой ионизации. Максимальное содержание бетаина соответствует минимальной электропроводности – называется изоэлектрической точкой – pHi
Особенности физических свойств алифатических аминокислот:
· бесцветные высокоплавкие кристаллические вещества;
· строение внутренних солей плавятся с разложением в диапазоне от 220 оС (серин, пролин) до 340 оС и выше (валин, тирозин);
· растворимость в воде варъирует в широких пределах и определяется природой радикала и главным образом наличием в молекуле гидрофильных и гидрофобных группировок. К первым относятся амино-, гидрокси- и меркаптогруппы, ко вторым – неполярные углеводородные фрагменты;
· растворимость в спирте много выше, чем в воде;
· практически не растворяются в эфире, хлороформе и других органических растворителях.
Особенности физических свойств ароматических аминокислот:
· существуют в основном в неиоизироваррой форме (три изомера аминобензойных кислот);
· мало растворимы в воде (0,4–0,6 %, что намного ниже растворимости близкого по структуре, но ионизированного фенилаланина);
· значительно лучше растворимы в спирте и эфире (от 2 до 16%).
Химические свойства аминокислот
Реакционная способность гетерофункциональных карбоновых кислот определяется:
· реакционной способностью каждой функциональной группы;
· взаимным влиянием функциональных групп друг на друга;
· участием в реакции обеих функциональных групп.
Аминокислоты как гетерофункциональные соединения вступают в большинство реакций, характерных для карбоновых кислот и аминов. Наличие в молекулах аминокислот двух различных функциональных групп приводит к появлению ряда специфических свойств, которые в общих чертах сходны со свойствами гидроксикислот. Имеющиеся в молекулах аминокислот карбоксильная группа (электрофильный центр) и аминогруппа (нуклеофильный центр) способны взаимодействовать с образованием амидной группировки. Это взаимодействие в зависимости от расположения функциональных групп в молекуле может протекать межмолекулярно или внутримолекулярно.
| <== предыдущая страница | | | следующая страница ==> |
| Изомерия | | | Кислотно-основные свойства аминокислот |
Дата добавления: 2015-07-26; просмотров: 365; Нарушение авторских прав

Мы поможем в написании ваших работ!