
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Б) Реакции гидроксильной группы
1. Реакция ацилирования.При ацилировании гидроксикарбоновых кислот галогенангидридами получаются сложные эфиры. Для ацилирования можно использовать и ангидриды кислот:

2. Реакция с галогеноводородами.Происходит нуклеофильное замещение спиртовой гидроксильной группировки на галоген и получаются галоген замещенные кислоты:

3. Реакция окисления.При окислении гидроксикислот получаются оксокарбоновые кислоты (альдегидо- и кетокислоты).

4. Совместные реакции гидроксильной и карбоксильной групп.Взаимодействие гидроксильных и карбоксильных групп может привести к образованию циклических сложных эфиров лактонов или лактидов. Слабые α-лактоны до сих пор не получены.

5. Рекция α-оксикислоты в растворе серной концентрированной кислоты.В ходе реакции оксикислота расщепляется с выделением СО и Н2О, в результате α-оксикислоты превращаются в альдегиды или кетоны:

6. Стереохимия реакций присоединения к этиленовой связи на примере галогенирования цис- и транс-бутенов, малениновой и фумаровой кислот. Интересно проследить взаимоотношение цис-транс-изомерови оптических изомеров. Его можно проиллюстрировать на отношении малеиновой и фумаровой кислот к винным. Оказывается, при окислении перманганатом в воде (по Вагнеру) фумаровая кислота образует рацемическую смесь левой и правой винных кислот, а малеиновая — мезовинную кислоту:
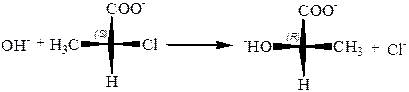

Течение процессов становится ясным при взгляде на формулы, а еще лучше – на модели. Однако только окисление по Вагнеру может служить методом отличия цис-изомеров от транс-изомеров по оптической деятельности продукта присоединения (конечно, после разделения рацемата на антиподы) или не деятельности и не расщепления продукта реакции на антиподы. Другие присоединения по ϭ-связи, например присоединение молекулы брома, проходят, наоборот, в цис-транс-положение. Чтобы понять это, необходимо познакомиться с так называемым валъденовским обращением (или оптической инверсией, 1896 г.).
7. Вальденовское обращение.Смысл явления состоит втом, что нуклеофильное замещение типа SN1 у асимметрического углеродного атома, где это легко обнаружить, а на деле у всякого предельного углеродного атома, протекает с обращением конфигурации. Пример вальденовского обращения:
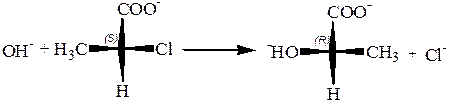
Согласно гипотезе Хьюза и Уинстейна реакция протекает с двойным обращением:

Реакции бимолекулярного нуклеофильного замещения у неасимметрического предельного углеродного атома, конечно, проходят по этому же типу: с атакой нуклеофильного заместителя с противоположной стороны от замещаемого атома, выплощением в переходном состоянии остальных групп, связанных с углеродом, и выворачиванием их в конечном продукте:
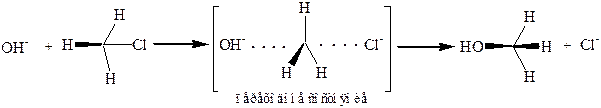
Вальденовское обращение является правилом для реакций нуклеофильного замещения, протекающих как реакции второго порядка (SN2). Единственное исключение – это реакции «с участием соседнего атома», подобные приведенной выше реакции с промежуточной циклизацией в лактон.
Однако это является исключением лишь в том смысле, что изолируемый конечный продукт реакции имеет ту же конфигурацию, что исходный. По существу, эти реакции протекают с двойным вальденовским обращением и, значит, являются не исключением, а подтверждением общего правила.
Реакции нуклеофильного замещения первого порядка (SN1) протекают с предварительной диссоциацией исходного соединения на катион и анион:

и в принципе должны иметь результатом рацемизацию, так как катион должен приобрести плоскую конфигурацию, и нуклеофил, заменяющий X, может атаковать его как справа, так и слева. Фактически рацемизация иногда бывает частичной, поскольку катион не всегда успевает до атаки выплощиться, а анион X не всегда успевает отойти достаточно далеко и экранирует одну сторону плоскости (иногда в экранировании принимает участие и растворитель.)
Оксикислоты в природе.α-гидроксикарбоновые кислоты широко распространены в природе, причем встречаются в природных источниках только в виде L-элементов. Многие алифатические оксикислоты имеют природное происхождение и встречаются в различных растениях, а также участвуют в обменных процессах живого организма.
Гликолевая кислота встречается в свекле и винограде, молочная кислота, как уже отмечалось выше, является продуктом жизнедеятельности некоторых бактерий, например, обеспечивающих молочнокислое брожение молока и многих овощей при консервировании, квашении капусты и засолке огурцов.
Молочная кислота является естественным консервантом, и се накапливание предохраняет продукты от дальнейшего разложения. В организме человека D-молочная кислота образуется в мышцах при физической нагрузке в результате расщепления глюкозы через стадию образования простейшей кетокислоты - пировиноградной кислоты, и се повышенная концентрация воспринимается как мышечная усталость.
Яблочная кислота содержится в недозрелых яблоках, рябине, клюкве и многих других плодах. Там же находится и D-винная кислота, которая в виде калиевой соли выпадает в осадок при брожении вина, откуда се и получают. Много лимонной кислоты, естественно, содержится в лимонах, однако поскольку в нашей стране лимоны не растут, то ее выделяют из махорки после предварительного извлечения никотина, а также из зеленой массы хлопчатника.
Салициловая кислота известна главным образом как предшественник ацетилсалициловой кислоты – аспирина. Метилсалицилат и салол также являются лекарственными препаратами.
Широко распространены в природе полиоксибензойиые кислоты, которые содержатся в виде гликозидов во многих растениях: протокатеховая кислота (1) и ее производные – ванилиновая (2), изованилиновая (3) кислоты. Из триоксибензойных кислот наибольшее значение имеет галловая кислота, которая в виде производных широко распространена в природе, в частности она находится в коре дуба, гранатового дерева, листьях чая и чернильных орешках – наростах на тканях растений, образующихся в результате некоторых заболеваний, вызываемых паразитами. Ранее из чернильных орешков, содержащих производные галловой кислоты, изготавливали чернила. Соли оксикислот. входящих в состав чернильных орешков, с двухвалентным железом, неокрашены и растворимы в воде. На воздухе они легко окисляются в производные трехвалентного железа, имеющие черный цвет и нерастворимые в воде. Реакция окисления идет во времени, и для того чтобы чернила были видны на бумаге сразу после нанесения, в них добавляли краситель синего цвета.
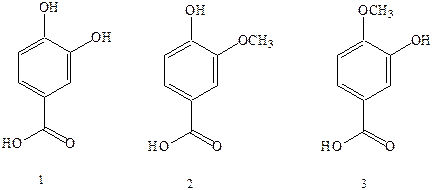
Другое название чернильных орешков – дубильные орешки – обусловлено тем, что из них извлекают таннин – вещество, обладающее дубильными свойствами, то есть способностью превращать шкуру животного в кожу. Процесс дубления основан на сшивке белковых цепей в трехмерную структуру, обеспечивающую высокую прочность кожи.
Применение оксикислот.Оксикислоты широко распространены в растительном мире. Гликолевая кислота встречается во многих растениях (свекла, виноград). Молочная кислота является продуктом жизнедеятельности ряда бактерий. Она с незапамятных времен используется как консервирующее и предохраняющее от гниения вещество. Кислое молоко, простокваша, кефир, варенец – продукты молочнокислого брожения молока: молочный сахар – лактоза превращается в молочную кислоту, и она свертывает, «створаживает» белок (казеин молока). Приготовление кислой капусты, моченых яблок, солка огурцов, помидоров, арбузов и т. д. – этовсе процессы молочнокислого брожения сахаров,содержащихся в этиховощах и плодах. Накапливающаяся молочная кислота обеспечивает сохранность заготовленных овощей. Силос – продукт молочнокислого брожения ботвы и зелени. Все сказанное относится к L- и D-молочным кислотам. В мышцах содержится мясомолочная кислота, которая образуется изглюкозы подобным образом и накапливается во время работы мышцы. Ее предшественником является простейшая кетокислота пировиноградная, восстанавливающаяся в молочную.
Яблочная кислота найдена врябине, незрелых яблоках, листьях махорки и многих другихплодах. Яблочную кислоту используют в органическом синтезе и медицине. Соли ее называют малаты.
Лимонная кислота находится во многих растениях, в том числе в плодах лимона, откуда и добывается. У нас эту кислоту добывают из махорки после извлечения никотина, а также из ботвы хлопчатника (А.С Садыков). Ее получают также особым лимоннокислым брожением сахаров (глюкозы, мальтозы, патоки) с помощью цитромицетов.
Все эти оксикислоты безвредны для человека и многие их них (молочную, винную, лимонную) применяют в кулинарии и для изготовления напитков.
Лимонная кислота распространена в природе (лимонный сок, табачные листья). Лимонную кислоту применяют в пищевой промышленности и фармакологии. Сложные эфиры лимонной кислоты используют в качестве пластификаторов. Ее соли называют цитраты.
Салициловая кислотавстречается в природных продуктах, в основном в виде метилового эфира. Синтетически получают из фенола. Соли ее – салицилаты. Салициловую кислоту и ее производные используют в медицине, например ацетилсалициловою (аспирин), фениловый эфир салициловой кислоты (салол).

Галловая кислота содержится в природных продуктах (дубильных веществах, танине), из которых ее и получают.

Водные растворы дубильных веществ используют для денатурации белков (главным образом при обработке кожевенного сырья). Дубильные вещества содержатся в чернильных (дубильных) орешках, листьях чая и в дубовой коре. Главной составной частью дубильных веществ являются танины. Некоторые танины представляют собой гликозиды галловой кислоты. Галловую кислоту используют для синтеза красителей, для получения пирогаллола и в качестве аналитического реагента, а так же в качестве консерванта для многих пищевых продуктов (жиры, молочные продукты, рыба). Обычно для консервации используют соединения галловой кислоты, например гликозиды.
| <== предыдущая страница | | | следующая страница ==> |
| Реакции со щелочами | | | ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Гетероциклическими соединениями называют соединения, содержащие циклы, в которых имеется один или несколько гетероатомов – N |
Дата добавления: 2015-07-26; просмотров: 373; Нарушение авторских прав

Мы поможем в написании ваших работ!