
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Пиридин
Способы получения пиридина и пиридиновых оснований. В небольших количествах пиридини его метил- и этилпроизводные получают из каменноугольной смолы, которая содержит около 0,2 % смеси различных пиридиновых оснований.
Пиридиновые основания извлекают также из каменноугольной смолы путем обработки разбавленной серной кислотой легкого (Ткип. до 160 °С) и среднего масел (Ткип. 160–230 °С). Свободные основания выделяют из кислого раствора нейтрализацией и перегонкой. Разделение пиридиновых оснований, выделяемых из легкого масла, требует применения очень совершенных установок для перегонки. Вследствие этого содержащиеся в легком масле пиридин и α-пиколин стали получать в чистом виде лишь в последнее время. Следующая фракция не может быть разделена на три входящих в ее состав компонента: ф-пиколин, f-пиколин и 2,6-лутидин даже при фракционировании на эффективных колонках.
Кроме того, смесь пиридина и его метилпроизводных может быть получена в результате парофазной реакции ацетальдегида, формальдегида и аммиака на кремниево-алюминиевом оксидном катализаторе. В качестве исходных соединений для этой реакции используются также акролеин и аммиак или бутадиен, формальдегид и аммиак.
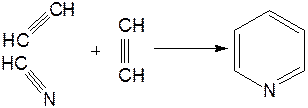
Синтез пиридинового цикла. Рамзай (1877 г.) получил пиридин измененным синтезом Бертло, пропуская смесь ацетилена с синильной кислотой через раскаленную трубку:
Пропуская через бензол азот, возбужденный электромагнитным полем высокой частоты, Б.М. Михайлов констатировал образование пиридина. Атом азота в этом случае заместил группу СН.
При всей наглядности этих синтезов они не имеют препаративного значения и дают ничтожный выход продукта.
Для подтверждения строения пиридинового цикла важен синтез Ганча, первая стадия которого состоит во взаимодействии ацетоуксусного эфира с альдегидом и аммиаком (берут альдегидаммиак) и приводит к этиловому эфиру 2,4,6-триметил-1,4-дигидропиридин-3,5-дикарбоновой кислоты. Образовавшийся эфир окисляют HNО3, удаляя два лишних водородных атома, что приводит к ароматической системе пиридина. Затем гидролизуют сложноэфирные группы и декарбоксилируют. Ясное подтверждение такой структуры дает и действие оснований на продукты N-присоединения к пиридину галоидных алкилов или арилов (Цинке) или веществ типа хлорангидридов, подобных хлорциану или эфиру хлорсульфоновой кислоты. Азот пиридина располагает свободной парой электронов и в связи с этим обладает основными свойствами. Поэтому он легко присоединяет, как все амины, йодистый метил, а также упомянутые галоидпроизводные.
Во всех подобных случаях получаются производные глутаконового альдегида или его таутомерной енольной формы:

Синтез диалилпиридинмонокарбоновых кислот из β-хлоранилкетонов, ацетоуксусного эфира и аммиака (А.Н. Несмеянов, Н.К. Кочетков):

Реакция Янца и Мак-Келлога. При нагревании смеси нитрида и диенового углеводорода до 400 оС гладко образуются замещенные пиридины:
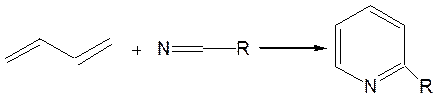
Электронное строение.Высокое значение энергии делокализации пиридинового цикла – 134,4 кДж/моль – говорит о его сильных ароматических свойствах и близко к величине энергии делокализации бензола. Как и молекула последнего, молекула пиридина имеет плоскостное строение. Однако в отличие от бензола длины связей в пиридине не все одинаковые: межатомные расстояния С–С равняются 0,1394 нм, а межатомные расстояния С–N 0,1340 нм. Поэтому молекула пиридина не является правильным шестиугольником, что влечет за собой неравномерное распределение электрических зарядов и возникновение дипольного момента в молекуле. С неравномерным распределением электронной плотности мы уже встречались при изучении пятичленного азотсодержащего гетероцикла - пиррола.
Однако между пирролом и пиридином в этом отношении существуют принципиальные различия, связанные с различной ролью азота в этих соединениях.
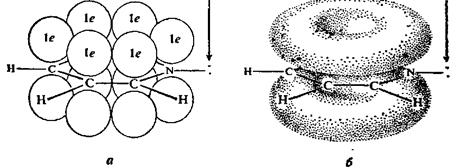
Рисунок – 2 – Молекула пиридина:
а) по одному электрону на каждой р-орбитали и два электрона на sp2 орбитали азота; б) р-орбитали перекрываются с образованием π-облаков, расположенных выше и ниже плоскости кольца: два свободных электрона находятся на sp2-орбитали атома азота.
Как уже упоминалось, атом азота в пиридине обладает электроноакцепторными свойствами и «стягивает» на себя всю электронную плотность цикла, в то время как атом азота в пирроле обладает электроно-донорными свойствами и отдает избыток электронного заряда в сопряженную π-электронную систему цикла.

При рассмотрении электронного строения пиридина следует отметить, что не только внесение атома азота в цикл означает изменение свойств углеводородного скелета этого гетероцикла. Дополнительное взаимодействие внешней неподеленной электронной пары атома азота с циклической π-электронной системой приводит к уменьшению основности пиридина. Тем не менее, благодаря наличию НЭП у азота, пиридин легко образует комплексы с кислотами Льюиса и многими металлами. Стабильность многих таких комплексов зависит от степени сопряжения с ароматическим ядром пиридина.
Физические свойства.Пиридин имеет сильный неприятный запах. Кипит при температуре 115 оС, плавится при температуре 38 оС; смешивается во всех соотношениях с водой, дипольный момент равен 2,20 D; энергия резонанса 37 ккал/моль. Водный раствор его – щелочной. С более или менее сильными кислотами он образует соли. Очень устойчив к окислению. Гомологи пиридина при окислении хромовой смесью образуют соответствующие пиридинкарбоновые кислоты.
| <== предыдущая страница | | | следующая страница ==> |
| Оксазол | | | Химические свойства |
Дата добавления: 2015-07-26; просмотров: 434; Нарушение авторских прав

Мы поможем в написании ваших работ!