
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОСНОВНЫЕ ПОНЯТИЯ. Восстановительная способность металлов проявляется при взаимодействии с различными веществами (кислотами
Восстановительная способность металлов проявляется при взаимодействии с различными веществами (кислотами, щелочами водой и др.).
Концентрированная соляная кислота, разбавленные растворы серной и соляной кислот взаимодействуют только с металлами, стоящими в ряду напряжений до водорода, вытесняя его из разбавленных растворов этих кислот. Металлы d-семейства, имеющие две степени окисления, при действии разбавленных серной H2SO4 и соляной НСl кислот образуют соли с низшей степенью окисления металла
Zn +HCIразб = ZnCI2+H2 
Fe + H2SO4разб = FeSO4 + H2 
Концентрированная серная кислота окисляет почти все металлы, за исключением благородных. Металлы средней и малой активности, включая серебро, окисляются ею лишь при нагревании, образуя соли с высшей степенью окисления металла. В концентрированной серной кислоте окислителем является сульфат-ион SO42- . В зависимости от активности металла и условий (температуры, концентрации кислоты) могут образовываться следующие продукты: H2S (с активными металлами), S (с металлами средней активности), SО2 (с малоактивными металлами). Например:
Мg + Н2SO4конц.  MgSO4 + H2S + Н2О
MgSO4 + H2S + Н2О
Сu + 2Н2SO4конц.  СuSO4 +SO2 + 2H2O
СuSO4 +SO2 + 2H2O
Цинк может восстанавливать концентрированную кислоту до SO2, S, H2S (одновременно).
Zn+ 2Н2SO4конц.  ZnSO4 +SO2 + 2H2O
ZnSO4 +SO2 + 2H2O
3Zn+ 4Н2SO4конц.  3ZnSO4 +S + 4H2O
3ZnSO4 +S + 4H2O
4Zn+ 5Н2SO4конц.  4ZnSO4 + H2S + 4H2O
4ZnSO4 + H2S + 4H2O
Азотная кислота является более сильным окислителем. Особенностью ее взаимодействия с металлами является то, что металлы не вытесняют водород даже из ее разбавленных кислот, в этом случае происходит восстановление азотной кислоты. Продуктами восстановления могут быть NO2, NO, N2O, N2 и NH4+, причем доля продуктов с низкими степенями окисления азота возрастает по мере разбавления кислоты; на состав продуктов также влияет активность металла. Например:
4Mg + 10HNO3 раз. = 4Mg( NO3)2 + N2O + 5H2O
5Mg + 12 HNO3раз. = 5 Mg(NO3)2 + N2 + 6H2O
4Mg + 10 HNO3разб. = 4Mg(NO3)2 + NH4NO3 + 3H2O
3Cu + 8HNO3раз. = 3Cu(NO3)2 + 2NO + 4H2O
Если металлы p- и d- семейства имеют две степени окисления, то при действии разбавленной азотной кислоты они образуют, главным образом, соли с высшей степенью окисления.
Fe + 4HNO3раз. = Fe( NO3)3 + NO + 2 H2O
Концентрированная азотная кислота, взаимодействуя с металлами, восстанавливается преимущественно до NO2
Mg + 4 HNO3 конц= Mg ( NO3)2 + 2NO2 + 2 H2O
Cu + 4 HNO3 конц= Cu( NO3)2 + 2NO2 + 2 H2O
При действии концентрированной азотной или серной кислот на поверхности некоторых металлах образуется плотная оксидная пленка, устойчивая к действию окислителей и предохраняющая металлы от дальнейшего разрушения. Это явление называется пассивацией. Например, концентрированная серная кислота пассивирует Fe, Be, Co, Bi, Nb, а концентрированная азотная – Al,Cr, Fe, Nb, Be, Co и другие.
2Al + 6 HNO3конц=Al2O3 + 6NO2 + 3H2O
2Fe + 3 H2SO4конц=Fe2O3 + 3SO2 + 3H2O
При нагревании концентрированные кислоты окисляют эти металлы:
2Fe + 6H2SO4конц=Fe2(SO4)3 + 3SO2 + 2H2O
Смесь концентрированной азотной и концентрированной соляной кислот (“царская водка”) окисляет самые благородные металлы – золото и платину.
Au + HNO3конц + HCl конц = H[AuCl4] + NO + 2H2O
Взаимодействуя с водой, некоторые металлы (Be, Al, Zn, Sn, Pb и др.) образуют гидрооксиды, обладающие амфотерными свойствами. Взаимодействие протекает по схеме:
Ме + 2H2O  Ме(ОН)2 + Н2
Ме(ОН)2 + Н2
Полученные гидрооксиды способны растворяться в щелочах и кислотах. Амфотерные свойства гидрооксидов указанных металлов объясняются тем, что в водных растворах они способны диссоциировать как по типу кислоты (I), так и по типу основания (II).
2Н+ + ZnO2-  H2ZnO2
H2ZnO2  Zn(OH)2
Zn(OH)2  Zn2+ + 2OH-
Zn2+ + 2OH-
I II
При взаимодействии указанных металлов или их гидрооксидов с растворами щелочей образуются комплексные соединения (гидрооксосоли), в которых лигандами являются ионы гидроксила.
Ве+2H2O+2NaOH= Na2[Be(OH)4] + H2
тетрагидрооксоберилат натрия
2 Al +6H2O+2NaOH= 2Na [Al(OH)4] + 3H2
тетрагидрооксоалюминат натрия
2Cr +6H2O+6NaOH= 2Na3[Cr(OH)6] + 3H2
тетрагидрооксохромат натрия
При сплавлении амфотерных металлов со щелочами образуются соли слабых кислот.
Ве+2NaOH 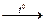 Na2BeO2 + H2
Na2BeO2 + H2
берилат натрия
Zn(OH)2 + 2NaOH 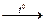 Na2ZnO2 + H2О
Na2ZnO2 + H2О
цинкат натрия
| <== предыдущая страница | | | следующая страница ==> |
| ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА | | | ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ. Задание 1.Взаимодействие металлов с соляной кислотой |
Дата добавления: 2015-07-26; просмотров: 220; Нарушение авторских прав

Мы поможем в написании ваших работ!