
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы получения растворимых гидрооксидов
1. Взаимодействие металлов 1-А группы или 11-А группы с водой:
Na + 2H2O = 2NaOH + H2
Ba + 2H2O = Ba(OH)2 + H2
2. Взаимодействие оксидов металлов 1-А группы или 11-А группы (кроме ВеО и МgO) с водой:
К2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
3. Взаимодействие пероксидов калия или натрия с водой:
2К2O + 2H2O = 4KOH + О2
4. Электролиз водных растворов солей:
2NaCl + 2H2O  2NaOH + Cl2 + H2
2NaOH + Cl2 + H2
5. Нерастворимые в воде гидрооксиды получают косвенным путем: реакциями обмена солей металлов с гидрооксидами более активных металлов:
CuSO4 + 2NaOH = Cu(OH)2 + K2SO4
Амфотерные гидрооксиды, как правило, плохо растворяются в воде. Амфотерные гидрооксиды способны растворяться в кислотах и в щелочах, т.е. обладают одновременно свойствами оснований и кислот.
Zn(OH)2 + 2NaOH = Na2Zn(OH)4
тетраоксоцинкат натрия
Zn(OH)2 + 2NaOH 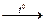 Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
цинкат натрия
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
| <== предыдущая страница | | | следующая страница ==> |
| Способы получения оксидов металлов | | | ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ. Задание 1.Отношение оксидов к воде |
Дата добавления: 2015-07-26; просмотров: 175; Нарушение авторских прав

Мы поможем в написании ваших работ!