
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Способы получения оксидов металлов
1. Окисление соответствующих металлов и оксидов кислородом:
2Са + O2 = 2СаO
Этот метод не используется для получения оксидов щелочных металлов, так как они (кроме лития) при окислении образуют пероксиды.
2. Образование высших оксидов происходит при окислении кислородом соответствующих низших оксидов, сульфидов:
SnS2 + 3O2 = SnO2 + 2SO2
3. Окисление соответствующих металлов оксидами других металлов:
2Аl + Cr2O3 = 2Cr + Al2O3
4. Разложение оксидов и гидрооксидов:
4CrO3 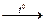 2Cr2O3 + 3О2
2Cr2O3 + 3О2
Cu(OH)2 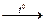 CuO + H2O
CuO + H2O
5. Разложение некоторых солей кислородосодержащих кислот:
CaCO3 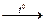 CaO + CO2
CaO + CO2
Гидрооксиды металлов – это соединения, в молекулах которых атомы металлов связаны с гидроксильными группами. Состав гидрооксидов выражается формулой Me(OH)n, где n- степень окисления металла.
Гидрооксиды наиболее активных металлов характеризуются основными свойствами. По мере уменьшения активности металлов, свойства их гидрооксидов непрерывно изменяются от типичных оснований через амфотерные соединения к кислотам. Изменения состава и характера гидроксидов металлов можно видеть на примере элементов четвертого периода KOH, Ca(OH)2, Se(OH)3, Ti(OH)4, Ti(OH)2O, V(OH)O2, HVO3, H2CrO4, HMnO4. В этом ряду наблюдается переход от типичных оснований – гидрооксидов калия и кальция к кислотам – хромовой и марганцевой.
В основных гидрооксидах металл с кислородом связан ионной связью, а водород с кислородом – ковалентной. В кислотных гидрооксидах, наоборот, связь кислорода с металлом ковалентная, а с водородом – ионная или сильно полярная.
Растворимые в воде гидрооксиды (щелочи) образуют щелочные металлы, за исключением LiOH. Умеренно растворимые – гидрооксиды щелочно-земельных металлов. Такие металлы как медь, алюминий и т.д. образуют нераствооримые гидрооксиды. При нагревании щелочи плавятся, нерастворимые гидрооксиды разлагаются. Самые непрочные гидрооксиды AgOH, Hg2(OH)2,Hg(OH)2 разлагаются в момент своего образования.
| <== предыдущая страница | | | следующая страница ==> |
| ОСНОВНЫЕ ПОНЯТИЯ. Кислородные соединения металлов – оксиды имеют большое значение | | | Способы получения растворимых гидрооксидов |
Дата добавления: 2015-07-26; просмотров: 178; Нарушение авторских прав

Мы поможем в написании ваших работ!