
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОСНОВНЫЕ ПОНЯТИЯ. Кислородные соединения металлов – оксиды имеют большое значение
Кислородные соединения металлов – оксиды имеют большое значение. Их состав выражается общей формулой MexOy. По химическим свойствам оксиды металла подразделяются на: основные, амфотерные, кислотные. Химический характер металлов в значительной мере сказывается на свойствах оксидов и гидрооксидов. Металлы щелочные (1-А группы) и щелочно-земельные (2-А группы), металлы побочных подгрупп в низшей степени окисления (+1,+2) образуют основные оксиды. По мере уменьшения активности металлов, свойства их оксидов изменяются от типично основных через амфотерные к кислотным.
Изменение состава и характера оксидов можно проследить на примере высших оксидов элементов четвертого периода. В этом ряду наблюдается постепенный переход от типично основных оксидов (K2O, CaO) через амфотерные (Se2O3, TiO2) к кислотным (V2O5, CrO3, MnO7). Такое же соответствие наблюдается в изменении свойств оксидов одного и того же элемента. Например, марганец образует несколько оксидов: основные – MnO, Mn2O3; амфотерный – MnO2; кислотные – MnO3, Mn2O7.
Связи в молекулах основных оксидов, например Na2O, CaO, ионные или сильно полярные, что обусловливает их прочность, твердость, тугоплавкость. Оксиды наиболее активных металлов при взаимодействии с водой образуют гидрооксиды – типичные основания
Na2O + H2O = 2NaOH
Высшие оксиды малоактивных металлов, например CrO3, Mn2O7, обладающие кислотными свойствами, характеризуются наличием ковалентных связей в молекуле, что обусловливает непрочность их кристаллических решеток. Эти оксиды с водой образуют гидроксиды, проявляющие кислотные свойства.
CrO3 + H2O = H2CrO4
Амфотерными называются оксиды, которые, в зависимости от условий, проявляют и основные, и кислотные свойства. Амфотерные оксиды образуют металлы III-А группы (Al, B); почти все металлы в степени окисления +3, +4.
Al2O3 + 2NaOH + 3H2O = 2Na [Al(OH)4]
р-р тетрагидрооксоалюминат натрия
Al2O3 + 2NaOH 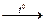 2 NaAlO2 + H2O
2 NaAlO2 + H2O
тв.
Al2O3 +6HCl= 2AlCl3+ 3H2O
Амфотерные свойства проявляет оксид железа Fe2O3, при действии кислот он образует соответствующие соли, при сплавлении с NaOH или Na2СO3 – диоксифферат железа (III) NaFeO2.
Оксиды металлов, взаимодействуя с кислотными оксидами или с кислотами, образуют соли:
СаО + 2HCl = CaCl2 + 2H2O
MgO + P2O5 =Mg3(PO4)2
| <== предыдущая страница | | | следующая страница ==> |
| ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ. Задание 1.Взаимодействие металлов с соляной кислотой | | | Способы получения оксидов металлов |
Дата добавления: 2015-07-26; просмотров: 189; Нарушение авторских прав

Мы поможем в написании ваших работ!