
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические свойства. Характерная особенность р-электронов – их подвижность, они менее прочно удерживаются ядрами атомов, чем s-электроны
Характерная особенность р-электронов – их подвижность, они менее прочно удерживаются ядрами атомов, чем s-электроны. Поэтому p-связь под действием электрофильных реагентов легко поляризуется и гетеролитически рвется, в связи с чем для алкенов характерны реакции присоединения.
Кроме этого, алкены легко вступают в реакции окисления и полимеризации по двойной связи.
1. Реакции электрофильного присоединения.
– Гидрогалогенирование (присоединение галогеноводорода).
СН3–СН=СН–СН3 + НСl ® СН3–СН2–СНСl–СН3
Если в реакции участвует несимметричный алкен (например, пропен), то преимущественное направление реакции определяется правилом В.В. Марковникова (1869 г.): при присоединении молекул типа НХ (где Х – атом галогена, группа ОН и др.) к несимметричным алкенам атом Н присоединяется к более гидрированному атому С молекулы алкена:
СН3–СН=СН2 + НВr ® СН3–СНВr–СН3.
пропен 2-бромпропан
Это можно объяснить исходя из следующих соображений:
1). Распределение электронной плотности в нереагирующей молекуле (статический фактор) – метильный радикал отталкивает от себя электронную плотность связи С–С. Вследствие этого происходит поляризация p-связи:
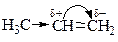
Полярная молекула НВr ориентируется атомом Н к молекуле пропена за счет электростатического притяжения к электронам двойной связи; происходит ионный разрыв связи Н–Вr, и ион Н+ притягивается преимущественно к первому атому С молекулы пропена и присоединяется к нему за счет электронной пары p-связи. На среднем атоме С молекулы пропена возникает заряд «+» (молекула превращается в карбкатион):
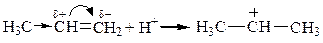
Затем бромид-ион присоединяется к положительно заряженному атому С карбкатиона:
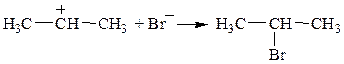
2). Устойчивость образующегося карбкатиона (динамический фактор). Взаимодействие иона Н+ с молекулой пропена теоретически может привести и к образованию карбкатиона 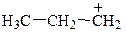 (ион пропения-1). Однако это не происходит, т.к. в силу того, что алкильные радикалы (СН3×, СН3–СН2×) отталкивают электронную плотность от себя и гасят положительный заряд атома углерода, ион пропения-2
(ион пропения-1). Однако это не происходит, т.к. в силу того, что алкильные радикалы (СН3×, СН3–СН2×) отталкивают электронную плотность от себя и гасят положительный заряд атома углерода, ион пропения-2 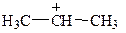 оказывается устойчивее, чем ион пропения-1. Это также говорит в пользу направления реакции по правилу Марковникова.
оказывается устойчивее, чем ион пропения-1. Это также говорит в пользу направления реакции по правилу Марковникова.
– Гидратация.
Этот процесс также протекает по правилу В.В. Марковникова:
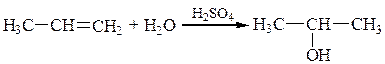
– Галогенирование (качественная реакция на двойную связь).
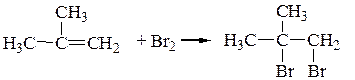
Наблюдается обесцвечивание бромной воды.
2. Реакции окисления и восстановления.
– Реакция Е.Е. Вагнера (1888 г.) – качественная реакция на двойную связь.
3СН2=СН2 + 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2KOH + 2MnO2¯
этиленгликоль
Наблюдается выделение бурого осадка оксида марганца (IV) и обесцвечивание раствора перманганата калия.
В кислой среде реакция алкенов с перманганатом калия идет с разрывом связи С=С, поэтому образуются соответствующие карбоновые кислоты или кетоны:
5Н3C–CH=CH–CH3 + 8KMnO4 + 12H2SO4 ® 10H3C–COOH + 8MnSO4 + 4K2SO4 + 12H2O
бутен-2 уксусная кислота
5Н3C–CH=C(СH3)–CH3 + 6KMnO4 + 9H2SO4 ®
2-метилбутен-2
® 5H3C–COOH + 5H3C–CO–CH3 + 6MnSO4 + 3K2SO4 + 9H2O
уксусная кислота пропанон (ацетон)
– Гидрирование.
Н3C–CH=CH–CH3 + Н2 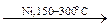 Н3C–CH2–CH2–CH3
Н3C–CH2–CH2–CH3
В качестве катализаторов в этой реакции, кроме никеля, могут использоваться платина и палладий.
3. Реакции полимеризации.
Реакция полимеризации – это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного соединения – полимера.
Наиболее распространенными полимерами углеводородной природы являются полиэтилен и полипропилен.
nН2С=СН2 ® (–СН2–СН2–)n
этилен полиэтилен
| <== предыдущая страница | | | следующая страница ==> |
| Способы получения. Пиролиз – процессы химических превращений органических соединений, происходящие при высокой температуре | | | Природа сопряженных двойных связей |
Дата добавления: 2015-07-26; просмотров: 348; Нарушение авторских прав

Мы поможем в написании ваших работ!