
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Кислотность
Фенолы более сильные кислоты, чем вода (Ка~10-16) и спирты (Ка~10-18), но значительно более слабые, чем карбоновые кислоты (Kа~10-5). Большинство фенолов имеют Ка~10-10. Гидроксигруппа, связанная с ароматическим ядром, является более кислой, чем группа ОН в воде и спирте, вследствие делокализации электронной пары феноксид-иона, изображенной с помощью граничных структур I - IV.
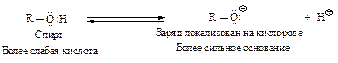
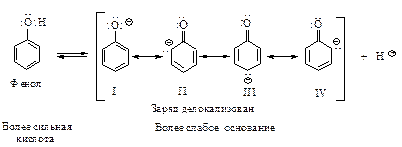
Ряд изменения кислотности и основности можно представить следующим образом:
Относительная основность: 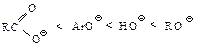
Относительная кислотность: 
Влияние заместителей на кислотность фенолов
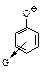 G – электроноакцепторная группа: –NO2,–Hal,
G – электроноакцепторная группа: –NO2,–Hal, 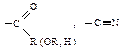 ;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность ;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность
|  G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность
G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность
|
Повышенная кислотность фенолов по сравнению с водой и со спиртами проявляется в способности фенолов образовывать с водными растворами щелочей и спиртовыми растворами алкоксидов соли, называемые феноксидами (фенолятами).
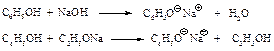
Фенолы, в отличие от карбоновых кислот, не растворяются в водном растворе гидрокарбоната натрия, но их можно выделить из соли действием угольной кислоты
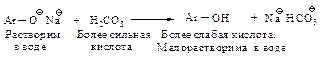
Нерастворимое в воде соединение, которое растворяется в водном растворе щелочи, но не растворяется в водном растворе гидрокарбоната, с большой долей вероятности является фенолом.
Способность фенолов растворяться в водных растворах щелочей используют для выделения фенолов из смесей с нейтральными или менее кислыми соединениями, а также как качественную реакцию на фенол.
Большинство фенолов (как и енолов) дают характерное окрашивание с водным и спиртовым раствором хлорида железа (III) FеС13 вследствие образования комплексных солей железа(цветная качественная реакция на фенолы). При этом фенол окрашивается в красно-фиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый, а салициловая кислота 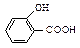 - в красный цвет.
- в красный цвет.
| <== предыдущая страница | | | следующая страница ==> |
| Физические свойства. Простейшие фенолы – высококипящие жидкости или низкоплавкие твердые соединения | | | Фенолы и феноксид-ионы – нуклеофильные реагенты |
Дата добавления: 2015-07-26; просмотров: 355; Нарушение авторских прав

Мы поможем в написании ваших работ!