
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Никель и его сплавы
Стандартный электродный потенциал никеля Ni2+ + 2е ↔ Ni равен
-0,25 В.
ПДК в воде — 0,01 мг/л. Никель обладает способностью к пассивации, что объясняет его повышенную коррозионную устойчивость (табл. 7.9).

Никель характеризуется прочностью, тугоплавкостью, пластичностью, способностью к механической обработке. Плотность равна 8,91, температура плавления 1455 °С.
В неокисляющих, разбавленных кислотах НС1 (до 15 %), H2SO4 (до 70 %), в ряде органических кислот никель достаточно устойчив. Коррозия никеля чаще всего протекает с кислородной деполяризацией.
Поэтому большое влияние на скорость коррозии никеля оказывает присутствие кислорода или воздуха, перемешивание, наличие окислителей. Коррозия никеля ускоряется в растворах в присутствии окислителей — FeCl3, CuCl2, HgCl2, AgNO3, NaClO.
Никель обладает высокой коррозионной стойкостью при повышенных температурах во многих органических средах, в том числе в жирных кислотах, спиртах. Поэтому из никеля изготавливают аппаратуру для пищевой промышленности.
Особым свойством никеля является его устойчивость к щелочам всех концентраций и температур. Никель является лучшим материалом при изготовлении аппаратов для выпарки и плавления щелочей. Стойкость в этой среде он сообщает сплавам железо-никель.
Как конструкционный материал никель находит ограниченное применение вследствие своей дефицитности и возможности замены его нержавеющими сталями.
Никель находит широкое применение в качестве защитного гальванического покрытия и как компонент для изготовления различных сплавов.
Высокой коррозионной стойкостью обладают сплавы никеля с медью, молибденом и сплавы систем Ni-Mo-Cr и Ni-Cr-Fe.
Сплавы никеля с медью. Никель с медью дает непрерывный ряд твердых растворов. Сплавы, содержащие менее 50 атом.% никеля, по коррозионным характеристикам ближе к чистой меди, а при содержании Ni более 50 атом.% ближе к никелю.
Наиболее известен сплав монель-металл, содержащий 70 % Ni, 28 % Сu и 1,5-2,5 % Fe. Он имеет повышенную коррозионную стойкость по сравнению с чистыми компонентами, входящими в его состав. Сплавы этого типа обладают также высокими механическими и технологическими свойствами, имеют большую прочность, хорошо прокатываются, отливаются, обрабатываются давлением и резанием.
Монель-металл стоек в неокислительных неорганических кислотах при невысоких концентрациях, в растворе Н3РО4 высокой концентрации и в растворах плавиковой кислоты всех концентраций при всех температурах при ограниченном доступе воздуха.
Сплав монель-К (66 % Ni, 29 % Си, 0,9 % Fe, 2,75 % ΑΙ, 0,4 % Μη, 0,5 Si, 0,15% С) отличен тем, что увеличивает свои прочностные характеристики при старении.
Никель-медные сплавы применяют в аппаратах, работающих в среде H2SO4, HC1, Н3РО4 и т.д. Сплав монель-К применяют для изготовления деталей, несущих значительную силовую нагрузку.
Сплавы никеля с молибденом носят названия хастеллоев. Они представляют собой твердые растворы и обладают прочностью, пластичностью и химической стойкостью. В промышленности они представлены марками Н65М-ВИ (ЭП982-ВИ), Н70МФВ-ВИ (ЭП814 А-ВИ), Хастеллой В-2, Nimofer S6928.
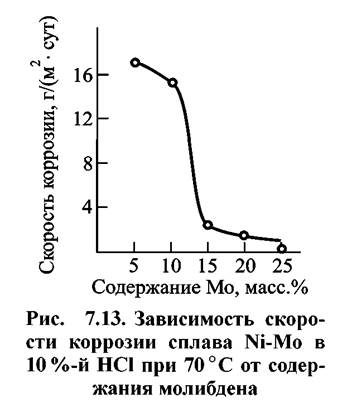 При содержании молибдена выше 15 % никель-молибденовый сплав стоек в растворах минеральных кислот. При содержании молибдена выше 20% коррозионная устойчивость сплавов особенно высока (рис. 7.13). Сплав «Хастеллой В» (марка Н70МФ), содержит 70% Ni и 25-29 % Мо. Он обладает устойчивостью в соляной и фосфорной кислотах всех концентраций при высокой температуре, в серной кислоте при температуре кипения (при концентрации более 60% до 150°С), в различных хлорпроизводных. Нестоек в окислительных средах.
При содержании молибдена выше 15 % никель-молибденовый сплав стоек в растворах минеральных кислот. При содержании молибдена выше 20% коррозионная устойчивость сплавов особенно высока (рис. 7.13). Сплав «Хастеллой В» (марка Н70МФ), содержит 70% Ni и 25-29 % Мо. Он обладает устойчивостью в соляной и фосфорной кислотах всех концентраций при высокой температуре, в серной кислоте при температуре кипения (при концентрации более 60% до 150°С), в различных хлорпроизводных. Нестоек в окислительных средах.
Дополнительное введение хрома привело к созданию сплава «Хастеллой С» (марка ХН65МВ). Его состав: 65 % Ni, 16 % Мо, 15 % Сг, 4 % Fe. Этот сплав стоек в окислительных средах, в холодной азотной кислоте всех концентраций, в кипящей азотной кислоте концентрации до 70%, в растворах, содержащих СЬ, С1О~, Fe3+, Cu2+ и в растворах HF.
Сплавы Ni-Mo хорошо обрабатываются, свариваются и ошлифовываются и являются ценным конструкционным материалом для химических производств.
Сплавы никеля с хромом — нихромы — могут содержать до 35% хрома при условии сохранения пластичности. Сплавы этого состава представляют собой твердые растворы Ni-Cr на основе 7-структурной решетки никеля.
Они представлены марками ХН58В (ЭП795), Nicrofer 6030 и имеют высокую стойкость в растворах азотной кислоты в присутствии фтор-иона при высокой температуре. Сплавы, содержащие 25-30% хрома, применяются для изготовления толстой проволоки и лент. Для получения очень пластичных нихромов, например, для протяжки проволоки диаметром 0,01-0,30 мм, содержание хрома в сплаве не должно превышать 20 %.
Никель-хромовые сплавы известны как жаростойкие материалы. Одновременно они обладают коррозионной стойкостью и в агрессивных средах. Эти сплавы так же как и нержавеющие стали устойчивы в окислительных средах, например, в азотной кислоте. Нихромы нашли широкое применение как жаростойкий и очень жаропрочный материал. Эти сплавы имеют аустенитную структуру и обладают высоким омическим сопротивлением.
Разновидностью нихромов являются сплавы типа нимоник. Они применяются для конструкций, работающих при высоких нагрузках и температурах.
Применяется также хромистый сплав на никелевой основе под названием инконелъ. Отличительной способностью инконеля является сохранение высокой прочности и сопротивления ползучести при повышенных температурах. Этот сплав применяется для изготовления химических аппаратов, работающих под давлением при высоких температурах.
Никель-хромомолибденовые сплавы (марки ХН65МВ, ХН65МВУ, Хастеллой С-276, Хастеллой С-22, Nicrofer S5923hMo) обладают высокой стойкостью в широкой гамме высоко агрессивных сред: в растворах хлоридов меди (до 20%) и железа (до 35%); в растворах серной, фосфорной, уксусной и муравьиной кислот, загрязненных хлор- и фтор-ионами; в сухом хлоре, влажном хлористом водороде.
Никелевые сплавы характеризуются высокой стойкостью против общей и локальной коррозии, хорошо свариваются, технологичны при изготовлении различных видов аппаратов. Применение материалов этой группы для сред с высокими параметрами агрессивности позволяет увеличить срок службы и надежность оборудования.
Олово
Стандартный равновесный потенциал олова равен -0.136 В. Стационарный потенциал в растворе 0,5N NaCl равен -0,25 В. ПДК в воде — 0,112мг/л.
Олово — серебристо-белый металл, медленно тускнеющий на воздухе. Оно может существовать в двух модификациях. Обычная металлическая модификация с плотностью 7,31 (β-фаза) носит название «белое олово». Более легкая металлоидная форма (α-фаза) с плотностью 5,75 носит название «серое олово». Белое олово устойчиво при температуре выше +13 ° С, серое олово — при температуре ниже +13 °С. Максимальная скорость перехода белого олова в серое олово устанавливается при -48 °С. Аллотропическое превращение белого олова в серое олово аналогично по внешнему проявлению коррозионному разрушению. Начавшееся превращение ускоряет процесс перехода. Это явление получило название оловянной чумы. Введение в олово 0,5 % Bi или Sb исключает подобное явление.
Одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 г. Она осталась без горючего из-за того, что оно просочилось через запаянные оловом баки, поражённые «оловянной чумой», названной так в 1911 г. Г. Коэном
.
Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
Олово обладает недостаточно высокими механическими свойствами, способность к пассивации выражена слабо. Оно устойчиво в природных водах, в растворах нейтральных солей, в пищевых средах. Олово широко применяется для защитных покрытий при изготовлении консервной жести.
В органических пищевых средах при отсутствии или недостатке кислорода олово имеет более отрицательный потенциал, чем железо. Поэтому в закрытых консервных банках не образуется ржавчины. В атмосферных условиях, напротив, железо обладает более отрицательным потенциалом, поэтому открытые банки во влажной атмосфере быстро ржавеют.
Олово устойчиво в разбавленных растворах серной и соляной кислот, в органических кислотах. При повышении концентрации минеральных кислот ускоряется коррозия олова. В азотной кислоте олово сильно разрушается. Неустойчиво оно также в щелочах. Олово устойчиво в атмосферных условиях.
Олово как конструкционный материал практического применения не имеет вследствие высокой себестоимости и невысокой механической прочности. Олово применяется для получения бронзы и сплавов, обладающих антифрикционными свойствами. Наибольшее применение из последних получили оловянные баббиты. В их состав входит до 90 % олова. Мягкие легкоплавкие сплавы олова и свинца используются в качестве припоев.
Сплавы на основе олова широко применяются в электротехнике. Станиоль — материал, применяемый для электроконденсаторов. Он состоит на 95 % из олова.
Свинец
Стандартный электродный потенциал свинца для процесса РЬ2+ + 2е ↔ Рb равен -0,126 В. ПДК в воде — 0,006 мг/л. Коррозионная стойкость свинца определяется во многом устойчивостью продуктов его коррозии.
Свинец — мягкий металл, имеющий невысокую температуру плавления (327,4 °С), низкую теплопроводность, высокую плотность (11,3) и плохие литейные свойства.
В качестве коррозионного материала применяется свинец чистоты не менее 99,2 %. Примеси Си, Sn, As, Fe, Bi увеличивают прочностные показатели, но уменьшают пластичность. Примеси мышьяка придают свинцу хрупкость. Коррозионная стойкость свинца определяется растворимостью продуктов его коррозии. Растворимость солей свинца отличается на несколько порядков в зависимости от природы аниона (табл. 7.10). 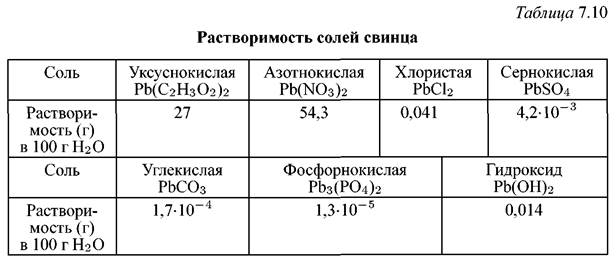
Из приведенных данных видно, что в азотной и уксусной кислотах свинец неустойчив, так как нитраты и ацетаты свинца растворимы. Свинец неустойчив так же в щелочах, так как гидроксиды свинца легко растворяются в избытке щелочи с образованием плюмбитов —РЬО22-, и плюмбатов — РЬО32-
Напротив, в серной и фосфорной кислотах свинец отличается высокой коррозионной стойкостью. Это относится и к растворам их солей. Нерастворимые продукты коррозии свинца осаждаются на поверхности и образуют беспористую, прочно связанную с металлом пленку, толщиной от тысячи до нескольких тысяч молекулярных слоев.
Так, в горячей серной кислоте при концентрации до 80 % и в холодной H2SO4 при концентрации до 96 %, образуется нерастворимая соль PbSO4.
При более высоких концентрациях серной кислоты и в олеуме свинец неустойчив. В этих условиях протекает реакция:
PbSO4 + H2SO4 ↔ Pb(HSO4)2
Бисульфат свинца обладает хорошей растворимостью и скорость коррозии свинца резко возрастает.
Добавки к свинцу 0,03-0,10 % Те улучшают коррозионную стойкость свинца как при более высоких концентрациях H2SO4, так и при более высоких температурах. Например, в 78 % H2SO4 легированный свинец стоек при 100-115 °С (табл. 7.11).
Добавка теллура повышает сопротивление свинца усталости и коррозии, когда сплав эксплуатируется в качестве обкладочного материала и труб. Отмечается также способность теллуристого свинца нагартовываться при холодной обработке и повышенное сопротивление его вибрационным и механическим нагрузкам.
В соляной кислоте свинец стоек до концентрации 10 %. В жестких водах, содержащих CaSO4 и кремниевую кислоту, свинец устойчив. 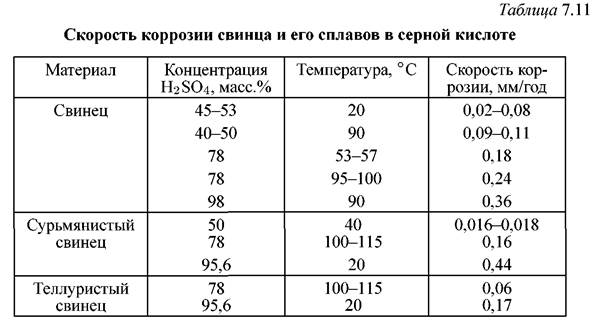
Но он корродирует в подземных водах, содержащих органические кислоты или большой процент углекислоты. В этих условиях образуются бикарбонаты свинца РЬ(НСО3)2 обладающие существенной растворимостью.
Свинец показывает высокую стойкость в атмосфере, особенно в индустриальных атмосферах, содержащих H2S, SO2, H2SO4.
Следует отметить высокую токсичность свинца.
Свинец находит применение в химической промышленности в виде листового материала для футеровки химических аппаратов, гальванических ванн, кристаллизаторов, для изготовления трубопроводов и газоходов. Он применяется также для оболочек кабелей связи, для защиты от рентгеновского облучения, для изготовления аккумуляторов.
Свинец применяется в сернокислотной промышленности как об-кладочный материал для небольших емкостей (вакуум-сборники, мерники) и в сопряженных узлах аппаратов (рис. 7.14); для гомогенного свинцевания крышек аппаратов, как конструкционный материал для труб холодильников. Низкий коэффициент теплопроводности не позволяет эффективно использовать свинец в теплообменной аппаратуре, а высокая плотность приводит к утяжелению конструкций. Верхний температурный предел применения свинца 120 °С. Для защиты от коррозии оборудования применяется рольный свинец марки С2 (ГОСТ 3778-56).
Сплав свинца, легированный 6-12% Sb, обладает повышенными механическими и литейными свойствами. Он известен под названием «твердый свинец» или гартблей (ГОСТ 1292-57). Из него изготавливают детали насосов промывных кислот и узлы аппаратов, испытывающие нагрузки (рис. 7.15).
Рассмотрим примеры. При производстве серной кислоты первой стадией процесса является обжиг пирита Fe2S. Полученный обжиговый газ проходит стадию очистки. Из 2-й промывной башни газ выходит при температуре 30-40° С. Мокрый электрофильтр устанавливается после 2-й промывной башни. В аппарат поступает газ, содержащий 7-8% SO2 при температуре 45-50 ° С. В электрофильтре газ очищается от наиболее крупных капель тумана, основной массы селена и мышьяка. Рассмотрим пример антикоррозийной защиты этого аппарата (рис. 7.14).
Корпус аппарата выполнен из стали СтЗ и защищен кислотоупорным кирпичом по подслою из изобутилена марки ПГС толщиной 5 мм на клее 88-Н. Между полиизобутиленом и кирпичом находится слой силикатной кислотоупорной замазки толщиной 5 мм. Крышка стальная выполняется гомогенно освинцованной, распределительная решетка — из отвержденного листового фаолита. Коронирующие электроды изготовляются из освинцованной стальной проволоки диаметра 1,8 мм. Осадительные электроды выполняются в виде шестигранных свинцовых труб, собранных в пакеты по 168 труб.
На рис. 7.15 приведена схема антикоррозионной защиты сборника промывной кислоты. Стальной корпус оклеивается полиизобутиленом и футеруется кислотоупорным кирпичом на силикатной кислотоупорной замазке. Шаровой клапан и вкладыш сборника выполнены из сурьмяни стого свинца — гартблея. Сифон изготовлен из стальной освинцованной трубы. Крышку аппарата защищают свинцом или резиной.
Сплав свинца с 1 % Ag и 1 % As используется в качестве материала для нерастворимых анодов, применяемых в электрохимических производствах для получения диоксида марганца и пероксида водорода.
Цинк
Цинк нашел широкое применение в качестве защитного покрытия железных и стальных изделий. Цинк—легкоплавкий (tпл = 419° С), мягкий и малопрочный металл. ПДК в воде — 0,01 мг/л. Стандартный электродный потенциал цинка Zn2+ + 2е → Zn равен -0,76 В. В 3 %-м растворе NaCl электродный потенциал цинка равен -0,83 В.
Цинк может корродировать как с водородной, так и с кислородной деполяризацией. В кислых средах цинк корродирует с водородной деполяризацией. На скорость коррозии цинка существенно влияют даже незначительные примеси других металлов. Примеси кадмия, свинца, алюминия не влияют на скорость коррозии. Примеси с низким перенапряжением водорода, например, железо, медь в концентрации 0,002-0,005 % увеличивают скорость коррозии цинка в 10 и более раз.
 |
В нейтральных растворах цинк корродирует с кислородной деполяризацией и имеющиеся в нем технические примеси не влияют на его коррозионную устойчивость. На поверхности металла образуются защитные пленки из гидроксида цинка.
В щелочах цинк не стоек и переходит в раствор в виде цинкатов, например, Na2ZnO2.
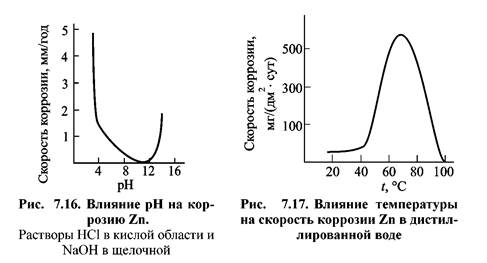
Цинк обладает максимальной устойчивостью в интервале рН между 9 и 11 (рис. 7.16). Применение цинковых покрытий нерационально, если рН среды заметно меньше 7 или более 12 из-за усиления коррозии цинка.
В воде цинк устойчив до 55 ° С (рис. 7.17). Скорость коррозии резко повышается с увеличением температуры и достигает максимума при 70 °С, а затем снижается. Наблюдаемые закономерности связывают с тем, что при температурах до 50 °С и выше 95 °С, на цинке образуется плотная пленка с высокими защитными свойствами. В интервале температур (55-65) °С наблюдается образование рыхлых продуктов коррозии с низкими защитными свойствами. При 100° С продукты коррозии уплотняются, а также происходит уменьшение растворимости кислорода в коррозионной среде.
В чистой и морской атмосферах цинк стоек, так как покрывается слоем продуктов коррозии из гидроксидов и основных углекислыхсолей цинка. В загрязненных SO2, SO3, HC1 средах индустриальных районов устойчивость цинка и цинковых покрытий заметно снижается. Цинк используется для защиты стали от атмосферной коррозии. Применяется для получения медных, никелевых, магниевых сплавов, в производстве аккумуляторов и как протектор при электрохимической защите железных сплавов.
Кадмий
Кадмий — серебристо-белый, мягкий металл. Плотность равна 8,65. Стандартный электродный потенциал кадмия Cd2+ + 2е ↔ Cd равен -0,40 В, а стационарный потенциал в 0,5н. растворе NaCl — -0,52 В. ПДК в воде составляет 0,005 мг/л.
В настоящее время использование кадмия запрещено.
Кадмий — тягучий и ковкий металл, который легко прокатывается в листы и вытягивается в проволоку.
Способность к пассивации у кадмия невелика. Поэтому в контакте с железом, обладающим склонностью к пассивации, в большинстве случаев кадмий оказывается анодом. Кадмий употребляют в основном для нанесения анодных покрытий на сталь и на алюминиевые сплавы.
Кадмий сходен по коррозионному поведению с цинком. В нейтральных растворах кадмий корродирует с кислородной деполяризацией. В отличие от цинка скорость коррозии кадмия с увеличением рН понижается.
Вследствие менее отрицательного электродного потенциала кадмий имеет большую устойчивость в кислых и нейтральных растворах по сравнению с цинком. В щелочах он вполне устойчив.
Кадмий устойчив к морской воде и морской атмосфере. Присутствие в газах SO2 и SO3 приводит к быстрому разрушению кадмия.
Кадмий используется для получения сплавов с медью. Высокая токсичность кадмия ограничивает его применение в качестве защитного покрытия.
| <== предыдущая страница | | | следующая страница ==> |
| Медь и медные сплавы | | | Титан и его сплавы |
Дата добавления: 2015-07-26; просмотров: 725; Нарушение авторских прав

Мы поможем в написании ваших работ!